为什么AD标志物检测成为重要竞争领域?目前AD标志物检测主要应用于哪些市场?国内获批的AD标志物检测产品现状如何?


据初步统计,自2021年后,AD标志物血液检测产品快速增加,有AD检测产品获批的企业从2021年前的2家增长至20余家,AD标志物检测已成为IVD行业新的竞争点。本次结合已有数据试图回答以下三个关键问题:1、为什么AD标志物检测成为重要竞争领域?2、目前AD标志物检测主要应用于哪些市场?3、国内获批的AD标志物检测产品现状如何?
痴呆症是一种综合征,包含由不同疾病引发的一系列症状,这些疾病的共同特征是进行性神经退行性病变和认知能力下降。痴呆症是导致失能的主要原因,也是全球第七大死亡诱因。2019年全球痴呆症患者估计超过5500万人,其中60-70%的病例由阿尔茨海默病(AD)引起。
美国国家老龄化研究所与阿尔茨海默病协会(NIA-AA)发布的《阿尔茨海默病诊断与分期修订标准》中将AD定义为一种生物学进程,起始于无症状阶段的AD神经病理改变(ADNPC)的出现。随着神经病理负荷的进展,最终导致临床症状的出现与演进。
AD检测领域的快速发展是科学研究推动、需求与政策催生及检测技术与标准的建立等多种因素共同作用的结果。其中,需求与政策的变化是重要因素。
1、需求增加
①我国人口老龄化程度继续加深。
根据国家统计局数据,2024年末我国60岁及以上老年人口为31031万人,占22.0%,其中65岁及以上老年人口为22023万人,占15.6%,我国人口老龄化程度继续加深。
根据 2020 年流行病学调查,估计中国 60 岁及以上人群的轻度认知障碍患病率为 15.5%。阿尔茨海默病患病率随年龄增长显著上升——60岁后每增加5岁,患病风险提升1.6至1.9倍。伴随着我国人口老龄化程度的加深,AD的患病人数将随之增加。
同时,AD病程进展缓慢,在Aβ斑块和神经原纤维缠结积累数十年后才会出现临床症状,早期筛查必要性的增加会进一步增加AD检测的需求人群数量。
②分期标准的建立与AD新兴治疗方案的驱动。
2024年 NIA-AA 发布的《阿尔茨海默病诊断与分期修订标准》中,明确将脑脊液Aβ42/40、p-tau181/Aβ42、t-tau/Aβ42比值及部分高精度血浆检测纳入AD诊断及分期中,高精度血浆标志物检测的纳入进一步增加了AD的临床检测需求。
另外,阿杜那单抗、仑卡奈单抗、多奈单抗等淀粉样蛋白免疫疗法药物先后获得FDA批准用于AD疾病的治疗。
淀粉样蛋白免疫疗法能以时间和剂量依赖性方式显著降低淀粉样斑块负荷、使下游生物标志物(包括CSF和血浆中的p-tau、总tau蛋白及血浆GFAP)向正常化方向转变。因此,新疗法的广泛应用将进一步带动AD标志物检测在疗效评估中的应用。不过,目前靶向疗法尚未批准用于认知未受损的AD个体。
另外,随着人们对健康意识的提升,对于AD的预防与治疗的认识将更加清晰,提前预防与筛查AD也将成为更多人的选择。
2、政策推动
WHO在2016年制定了《2017-2025 年公共卫生领域应对痴呆症全球行动计划》,提出了痴呆症的全球七大领域的目标,但根据最新数据,WHO预计将无法实现2025年全球目标。
其中在诊断领域,全球行动计划的一项具体目标是要求至少 50%的国家达到 50%以上痴呆症诊断率。
然而,2024 年,在 78 个观察站参与国中,只有 37 个国家报告了痴呆症诊断率,诊断率中位数为26%,14 个低收入和中等收入国家仅为 6%。在 78 个观察站参与国中,有 50 个国家提供了社区痴呆症服务,但在低收入和中等收入国家,获得服务的机会往往仅限于城市,43 个国家中只有 6 个国家报告农村获得了有关服务。
为此,第七十八届世界卫生大会已通过决定草案,将《2017-2025 年公共卫生领域应对痴呆症全球行动计划》延至 2031 年。
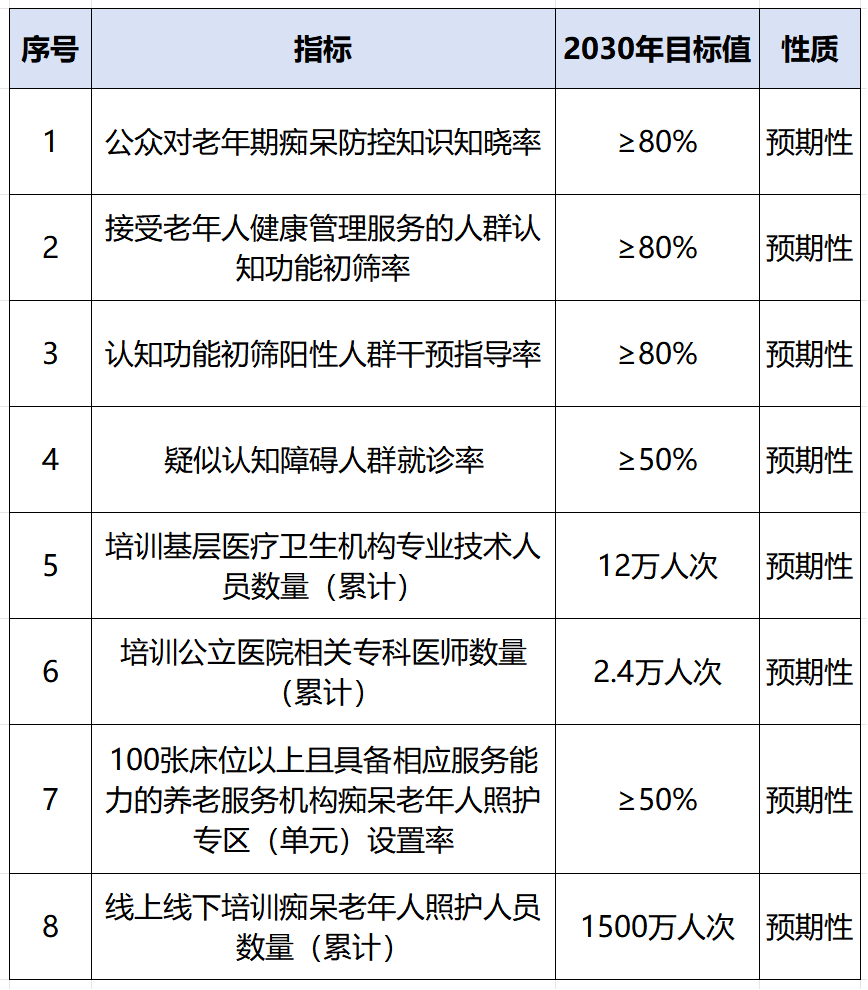
我国国家卫生健康委等15个部门在2024年12月末联合印发了《应对老年期痴呆国家行动计划(2024—2030年)》,提出了针对痴呆症防控的8大目标。(表1)
表1 我国针对痴呆症防控的8大目标
以上关键政策的发布,加之近年来我国三级诊疗体系的建立、基层诊疗等政策走向,AD检测关注度得到进一步增加。
AD 标志物检测产品可用于临床检测市场、社区筛查市场及体检市场。
查询DataMed数据库(https://cndatamed.com/data/allcenter),获取近两年Tau蛋白类及β淀粉样蛋白类检测试剂或设备相关招标及中标数据。
从中标单位看,医院仍是该类产品的核心应用场景。但近两年也有社区卫生服务中心等基层机构、疾控及海关等其他国家机构采购相关检测产品。(图1)
其中,明确表明用于体检的招投标项目占比仍相对较低,仅占1%-2%。(图1)
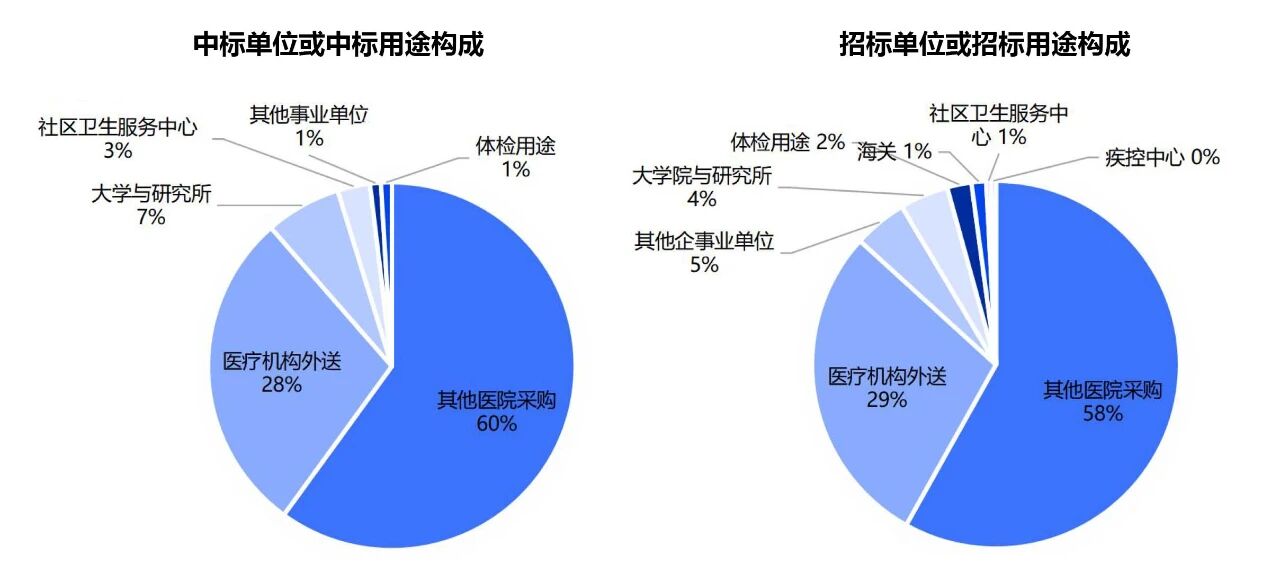
图1 近两年Tau蛋白类及β淀粉样蛋白类检测试剂或设备相关招标及中标单位构成情况。注:收集自公开数据,结果仅供参考。
因此,临床检测市场仍是当前AD检测产品的核心市场,已有社区筛查及体检市场相关采购项目,但相关市场可能仍待进一步开发。
参照NIA-AA发布的《阿尔茨海默病诊断与分期修订标准》,目前常用的AD诊断相关体液检测生物标志物可分成核心生物标志物、AD病理中的非特异性生物标志物及非AD共病理标志物三大类。具体包括(相关标志物详情详见表2):
核心生物标志物:Core1:A类、T1类;Core2:T2类;
AD病理中的非特异性生物标志物:N类及I类;
非AD共病理生物标志物:V类及S类。(主要用于评估在AD病理基础上,患者大脑内是否同时存在其他独立疾病病理)
表2 体液生物标志物与影像生物标志物的分类
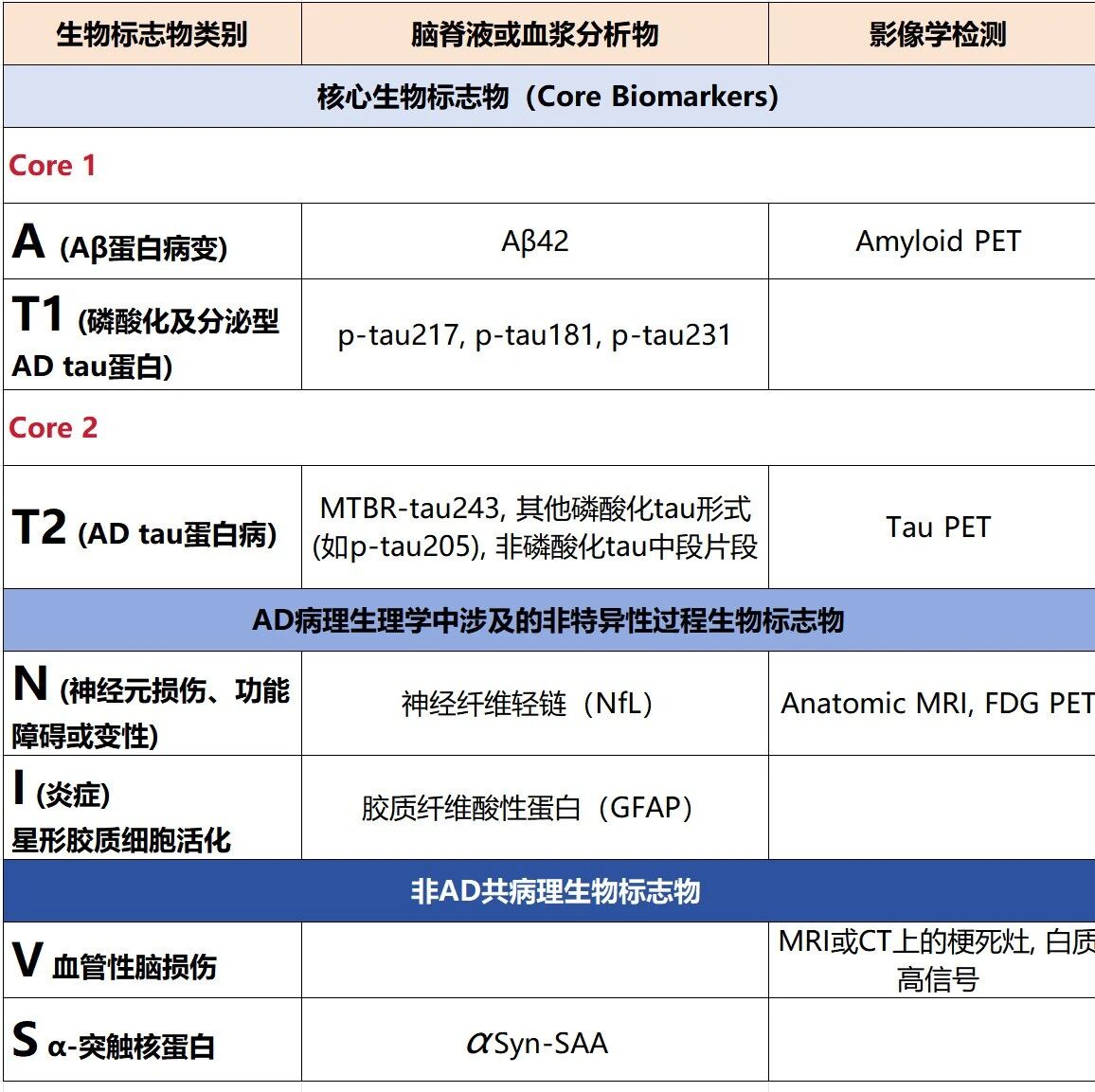
注:译自文献[1]
其中(表3):
A类、T1类标志物及其比值推荐用于AD诊断,既往研究表明血浆中p-Tau217及其占比因诊断性能较高,更推荐用于AD诊断。
A、T1、T2、N及I类标志物推荐用于AD分期、预后及治疗效果评估中。
N、V及S类标志物推荐用于AD共病理识别。
表3 影像学、脑脊液与血浆生物标志物检测的预期用途
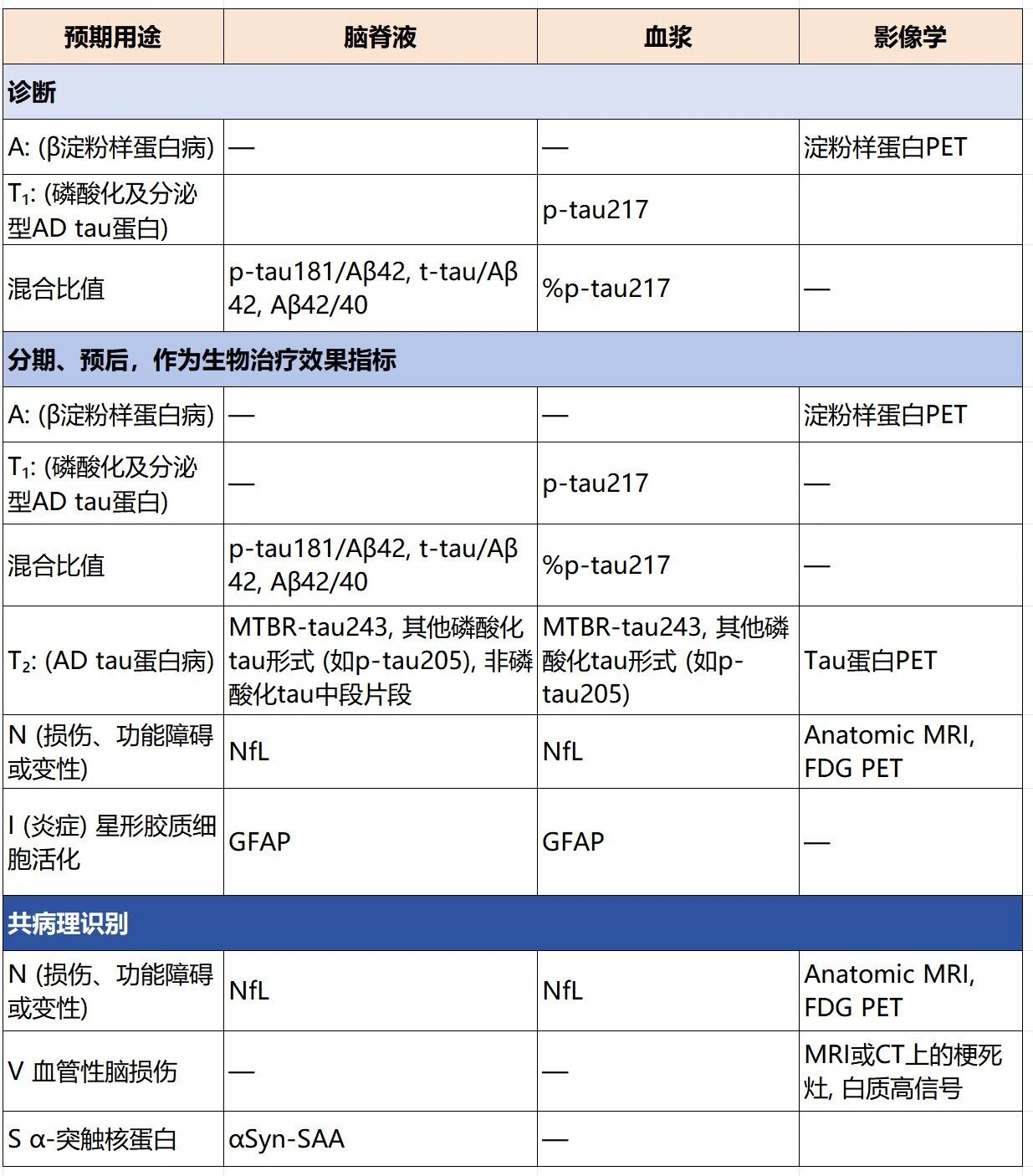
注:译自文献[1]
除以上血液及脑脊液相关标志物外,尿液中的部分标志物也有相关研究证明可用于AD的辅助诊断。(表4)
表4 AD尿液检测相关标志物
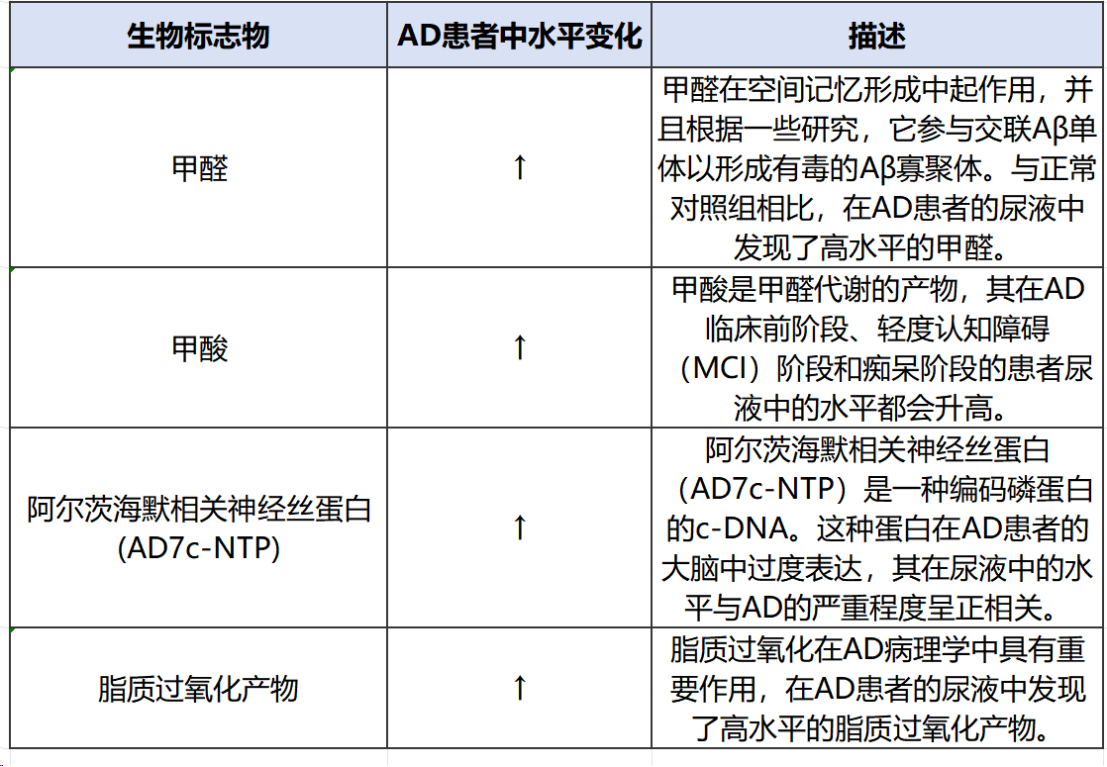
注:整理自文献[2]
截至2025年7月,检索DataMed数据库(https://cndatamed.com/data/allcenter),国内AD检测获批体外诊断产品共约70款。(未考虑APOE基因分型检测及涉及AD标志物检测的设备)
从样本类型看,包括血液检测产品59款,尿液检测产品11款,尚未有脑脊液及唾液检测产品获批。(图2)
其中,11款以尿液为样本类型的检测产品中包括10款AD7c-NTP检测产品,1款β淀粉样蛋白检测产品。尚未见甲醛及甲酸等标志物的尿液检测产品。(图2)
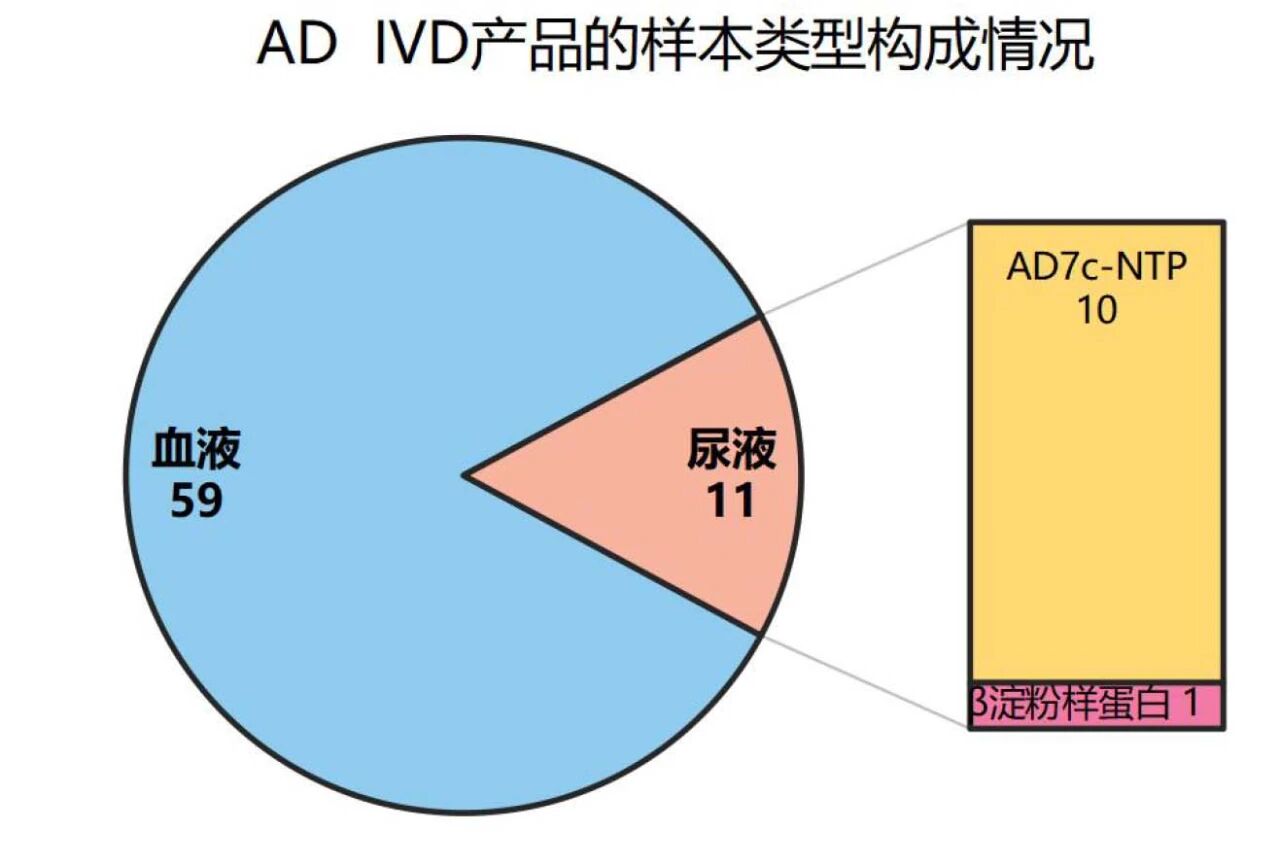
图2 我国获批的AD检测产品的样本类型构成情况
1、血液样本AD检测试剂
59款血液样本检测试剂中,包括多靶标联合检测试剂5款,单检产品54款。(图3)
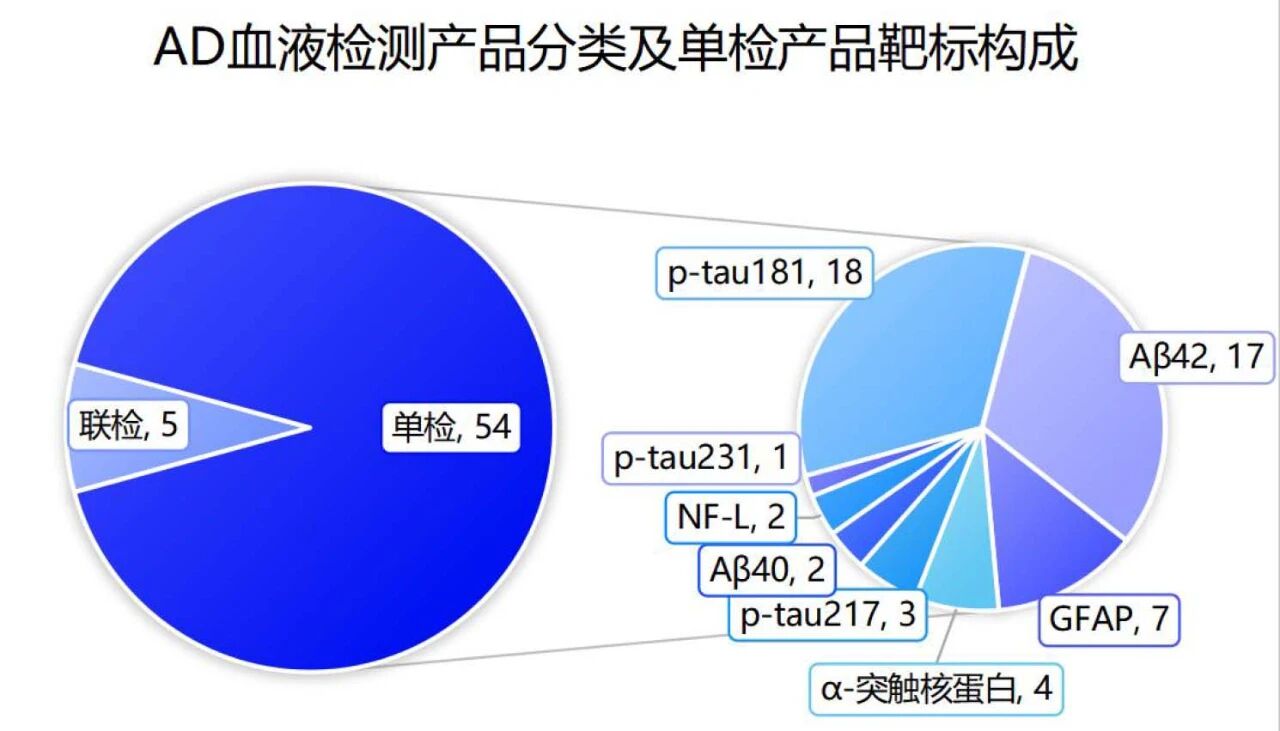
图3 AD血液检测产品分类及单检产品靶标构成情况
单检产品中,p-tau181、Aβ42、GFAP等标志物检测产品数量相对较多(图3)。
考虑到实际临床应用过程中可能通过计算比值的方式做辅助诊断,核心诊断标志物中,p-tau217、Aβ40等标志物检测产品仍有进一步增加的空间。
非特异性标志物中,NfL检测标志物产品数量仍相对少。此外,尚未见MTBR-tau243、p-tau205标志物相关获批产品。
联检产品中,5款产品覆盖的靶标均有一定差异,除湘械注准20232400284尚不确定是否核心用于AD诊断外,Aβ42、Aβ40及p-tau181为剩余3款多联检产品共同覆盖的核心标志物。(表5)
表5 5款AD相关联检产品靶标覆盖情况

注:蓝色代表该产品覆盖该靶标
技术路线上,因血液中AD相关标志物浓度低,且相关标志物检测一般需支持定量,其中,59款检测产品中有53款为定量检测。
因此,血液AD标志物检测对检测方法的性能要求较高。NIA-AA指南中明确,在对应使用场景中,相对于公认的参考标准,AD血液标志物诊断准确率必须达到至少90%。
从检测方法上看,化学发光法仍为主流检测方法。同时,为提高定量的准确性,单分子数字免疫检测方法逐步应用于AD血液标志物检测,如数字免疫芯片、数字流式荧光及数字酶联免疫法已有多款产品获批。
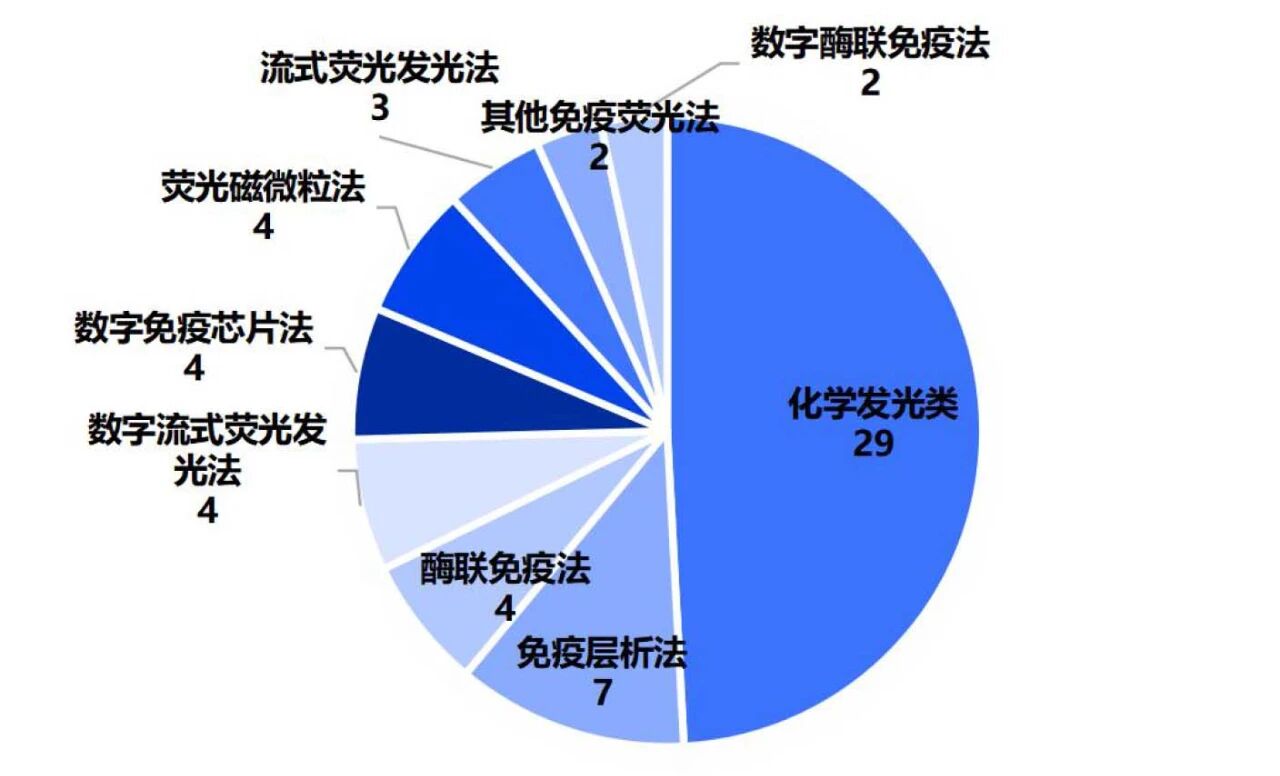
图4 AD标志物血检产品技术路线分布情况
总之,伴随着科学研究推动、需求与政策催生及检测技术与标准的建立,AD检测已成为IVD行业竞争的新领域。
从市场看,临床市场仍是当前国内AD检测的核心市场,基层筛查及体检市场仍需要进一步开发。
从产品端看,国内AD检测获批体外诊断产品共约70款,以血液及尿液为核心检测样本,尚无脑脊液及唾液检测产品获批。其中:
p-tau181、Aβ42、GFAP等标志物检测产品数量相对较多,p-tau217、Aβ40、NfL单检产品数量仍有进一步增长空间。
尚未见MTBR-tau243、p-tau205等标志物相关获批产品。
化学发光法仍是当前AD标志物检测的主流方法,单分子数字免疫检测方法已应用于AD血液标志物检测,可能在定量上具备一定优势。
近年来,新兴AD检测标志物及方法层出不穷,下期将围绕尚处于临床试验阶段的AD检测标志物做进一步分析,欢迎持续关注。
参考文献:
[1] Jack CR Jr et al. Revised criteria for diagnosis and staging of Alzheimer's disease: Alzheimer's Association Workgroup. Alzheimers Dement. 2024 Aug;20(8):5143-5169.
[2] Krishnamurthy HK, Jayaraman V, Krishna K, Wang T, Bei K, Changalath C, Rajasekaran JJ. An overview of the genes and biomarkers in Alzheimer's disease. Ageing Res Rev. 2025 Feb;104:102599.
[3] WHO, Preferred product characteristics of blood-based biomarker diagnostics for Alzheimer disease
[4] 中华医学会神经病学分会痴呆与认知障碍学组, 阿尔茨海默病源性轻度认知障碍诊疗中国专家共识2024
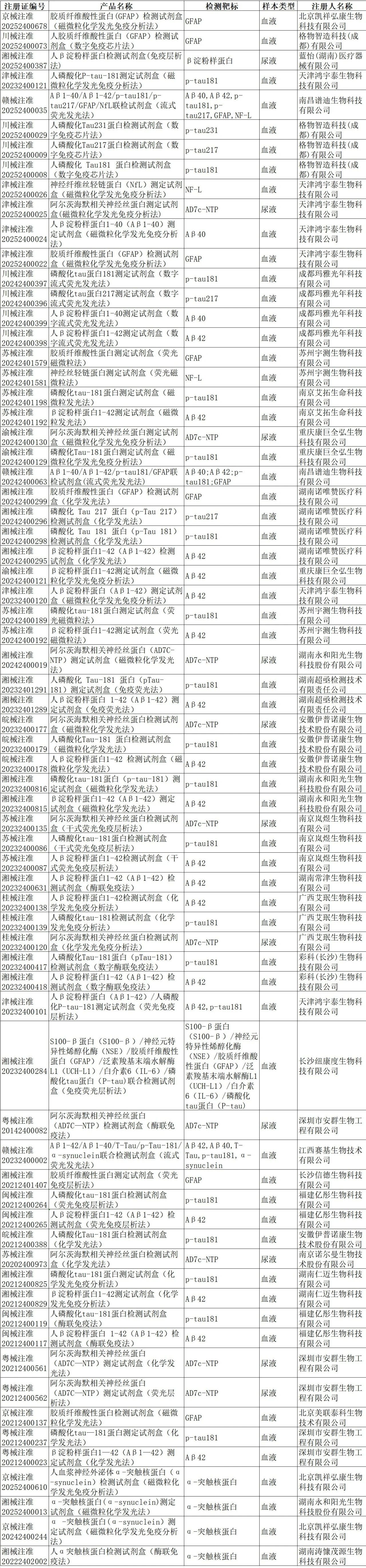
附录一 国内获批的AD 标志物检测产品




发表评论 取消回复