本期分享复旦大学附属浦东医院王永明教授报告:《基因编辑工具开发与基因治疗》

2025年12月21日,由中国医药生物技术协会生物诊断技术分会主办,第三期“生物诊断前沿技术专题会”在复旦大学召开。专题会聚焦《CRISPR诊断技术的创新与转化》。
生物诊断公众号将对各专家汇报内容进行汇编整理,供关注CRISPR诊断技术的业内同仁学习参考。
本期分享复旦大学附属浦东医院王永明教授报告:《基因编辑工具开发与基因治疗》。

王永明博士,复旦大学附属浦东医院教授,浦东医院先进基因编辑中心主任,国家级人才。取得多项有影响力的原创性成果:以通讯作者身份发表在Circulation、Nature Chemical Biology、Circulation Research、Nucleic Acids Research、PloS Biology、Advanced Science、Nature Communications、eLife、Science Advances等杂志上。
01
1. 背景
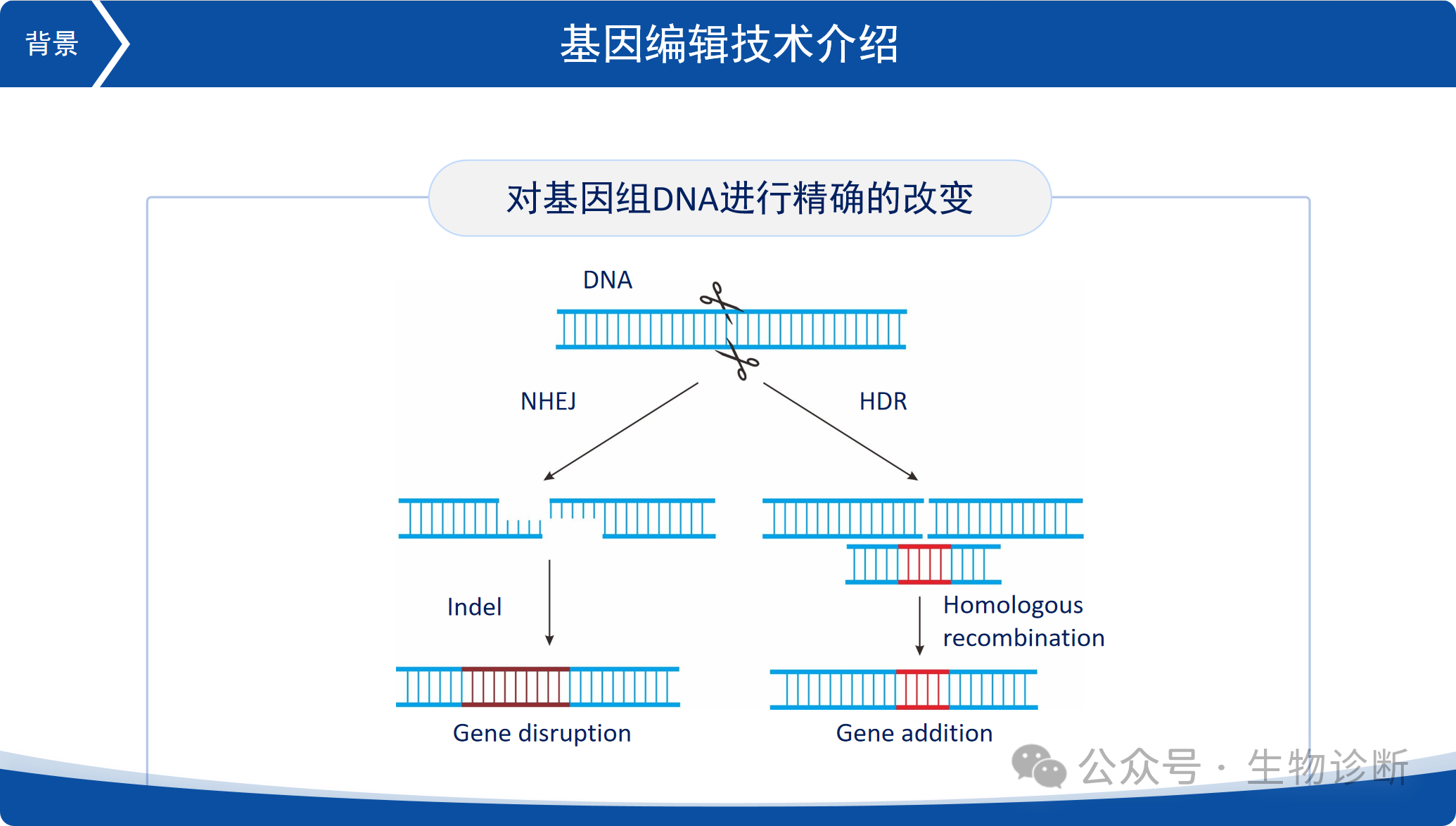
基因编辑技术是一种能够对DNA进行精确改造的技术。其核心是开发能够精准切断基因序列的核酸酶。当特定位置的DNA被切断后,细胞内的修复系统会启动修复过程,主要有两种修复途径:非同源末端连接(NHEJ)和同源重组(HDR)。
非同源末端连接(NHEJ):细胞内的酶会对断裂的DNA进行加工,增加或减少碱基后重新连接,从而产生突变,主要用于基因敲除。
同源重组(HDR):需要引入同源模板,断裂的DNA会以同源模板为参考进行精确修复,实现特定序列的插入或替换。
2. 基因编辑工具发展历程
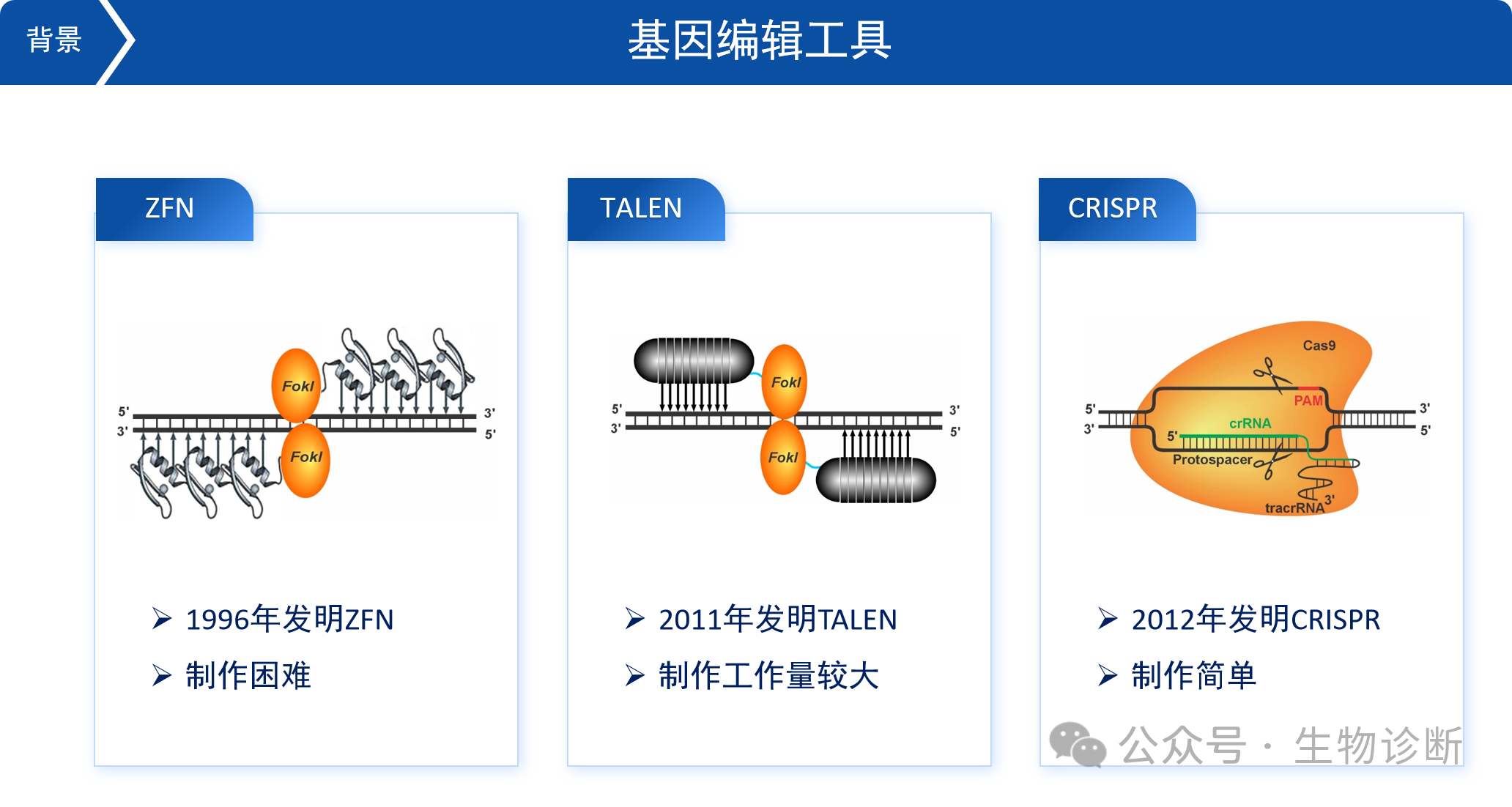
2.1 锌指核酸酶(ZFN,1996年发明)
第一代基因编辑工具,依靠锌指蛋白识别基因组DNA。一个锌指蛋白能识别3个碱基,需串联多个锌指蛋白才能识别较长序列。由于后续连接的核酸酶需形成二聚体才能发挥切割功能,技术操作复杂且脱靶率较高。
2.2 TALEN技术
2011年发明,依靠TAL效应子蛋白识别基因组DNA。该蛋白中间的重复序列可逐个识别碱基,通过串联识别A、C、G、T的TAL效应子,即可识别特定基因组序列。相比ZFN,TALEN技术操作更简便,一般一周左右即可完成构建,但仍需在相反方向放置单体才能发挥切割功能。
2.3 CRISPR技术
2012年发明,是目前应用最广泛的基因编辑技术。该系统由Cas9蛋白和sgRNA组成,形成复合物后,sgRNA通过互补配对识别目标DNA序列,Cas9蛋白在特定位置切断DNA。CRISPR技术的优势在于无需改变核酸酶,仅需调整RNA序列即可实现不同基因的编辑,因此获得了2020年诺贝尔化学奖。
3. CRISPR机制
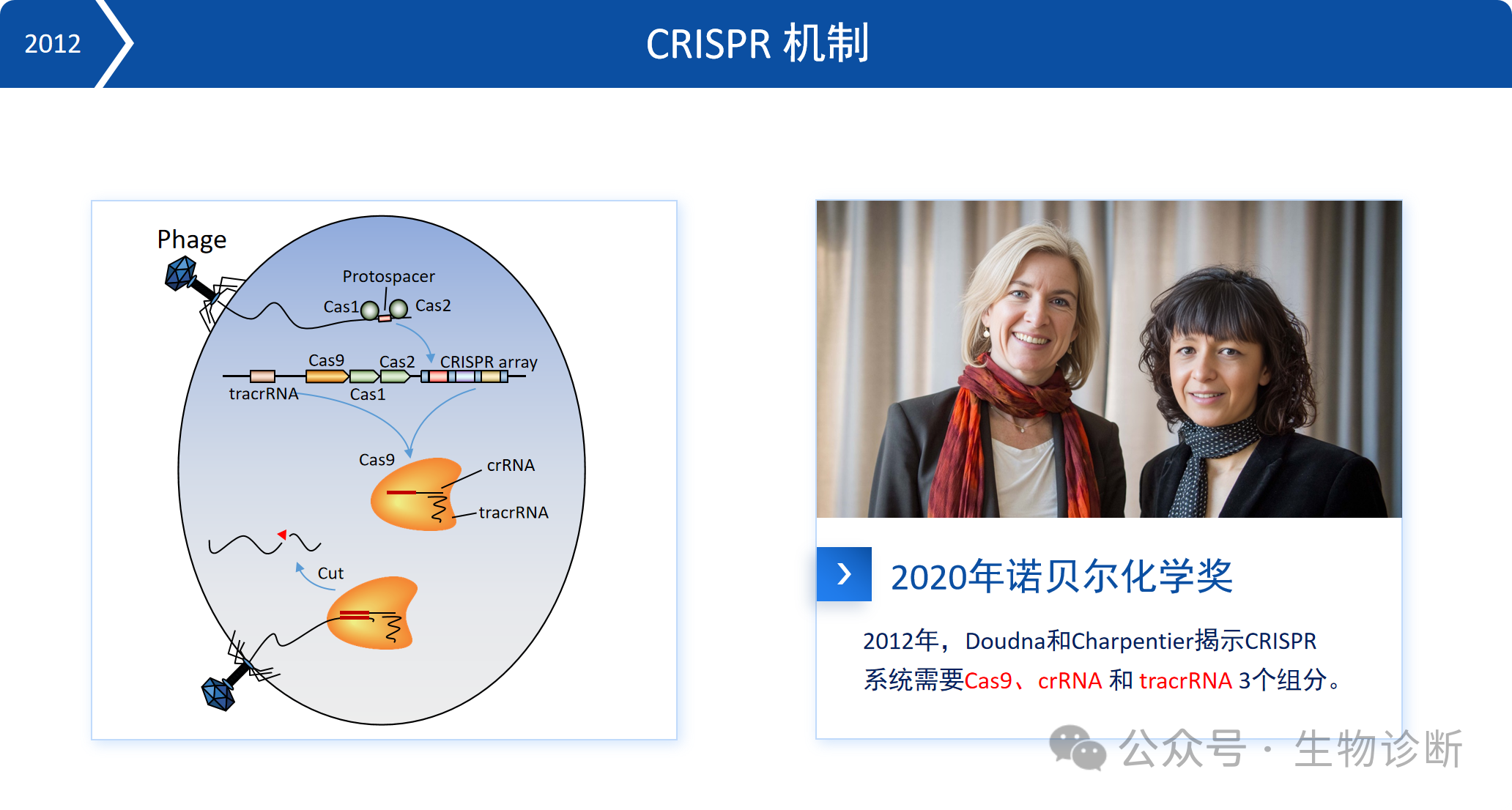
CRISPR是细菌的获得性免疫系统,其工作机制如下:
适应阶段:噬菌体入侵时,Cas1、Cas2 核酸酶切割噬菌体 DNA 片段,整合至细菌 CRISPR 阵列中形成间隔序列(spacer);
表达阶段:CRISPR序列转录后被切割,形成包含噬菌体DNA序列的crRNA;
干扰阶段:crRNA与tracrRNA及Cas蛋白形成复合物,通过互补配对识别噬菌体DNA,Cas蛋白切割噬菌体DNA,从而阻止其增殖。
2012年,Doudna和Charpentier揭示了CRISPR系统的工作原理,该成果于2020年获得诺贝尔化学奖。
4. CRISPR分类
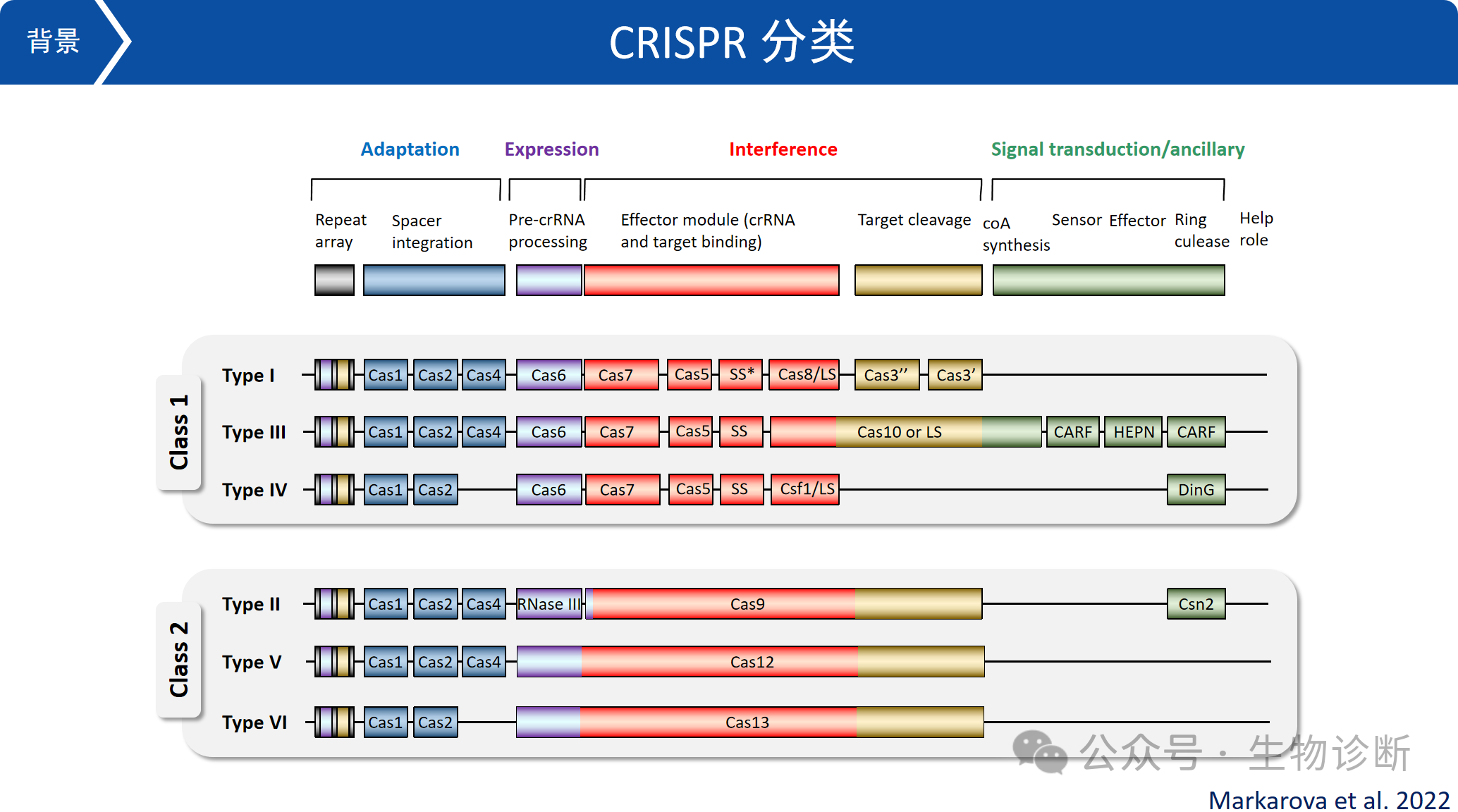
CRISPR系统分为两大类,每大类又包含三个亚类:
Class One:包括 Ⅰ、Ⅲ、Ⅳ 型,其效应模块由多个Cas蛋白组成复合物,来识别并切割外源DNA,结构相对复杂;
Class Two:包括 Ⅱ、Ⅴ、Ⅵ 型,依靠单个蛋白即可完成切割,操作更简便。其中Type II(编码Cas9)和Type V(编码Cas12)已被开发为基因编辑工具,Type VI(编码Cas13,主要靶向RNA),用于RNA编辑。
5. 核心 CRISPR 编辑工具
5.1 CRISPR-Cas9工具
2013年,张锋将CRISPR-Cas9系统应用于动物细胞基因编辑。作为基因编辑工具,CRISPR-Cas9主要依赖三个元件:Cas9蛋白、tracrRNA和crRNA。crRNA和tracrRNA可融合为sgRNA,简化操作流程。
Cas9蛋白并非可切割任意DNA序列,需先识别PAM序列(通常由3-4个碱基组成),然后解开DNA双链。若sgRNA能与目标DNA互补配对,Cas9蛋白则会切割DNA双链。不同细菌来源的Cas9识别的PAM序列不同。
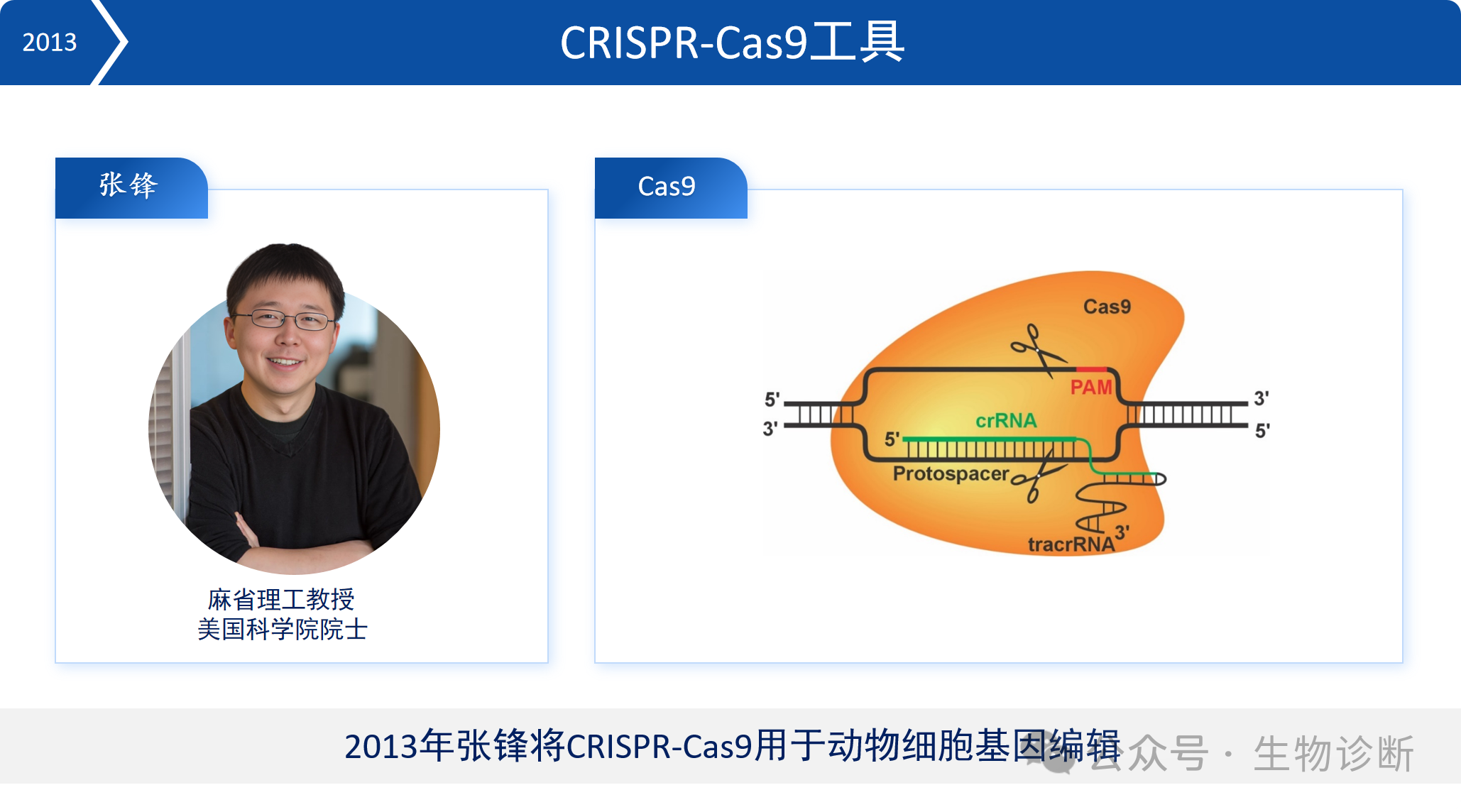
2013年至2019年间,共开发出10种Cas9变体,其中SpCas9是首个被开发且应用最广泛的Cas9蛋白。其优点是PAM序列简单(NGG)、活性高,但缺点是分子量较大(1368个氨基酸),难以通过AAV载体递送至体内。2015年,张锋团队开发出分子量较小的SaCas9(1053个氨基酸),更适合体内基因治疗,但PAM序列较为复杂(NNGRRT),可编辑位点相对较少。
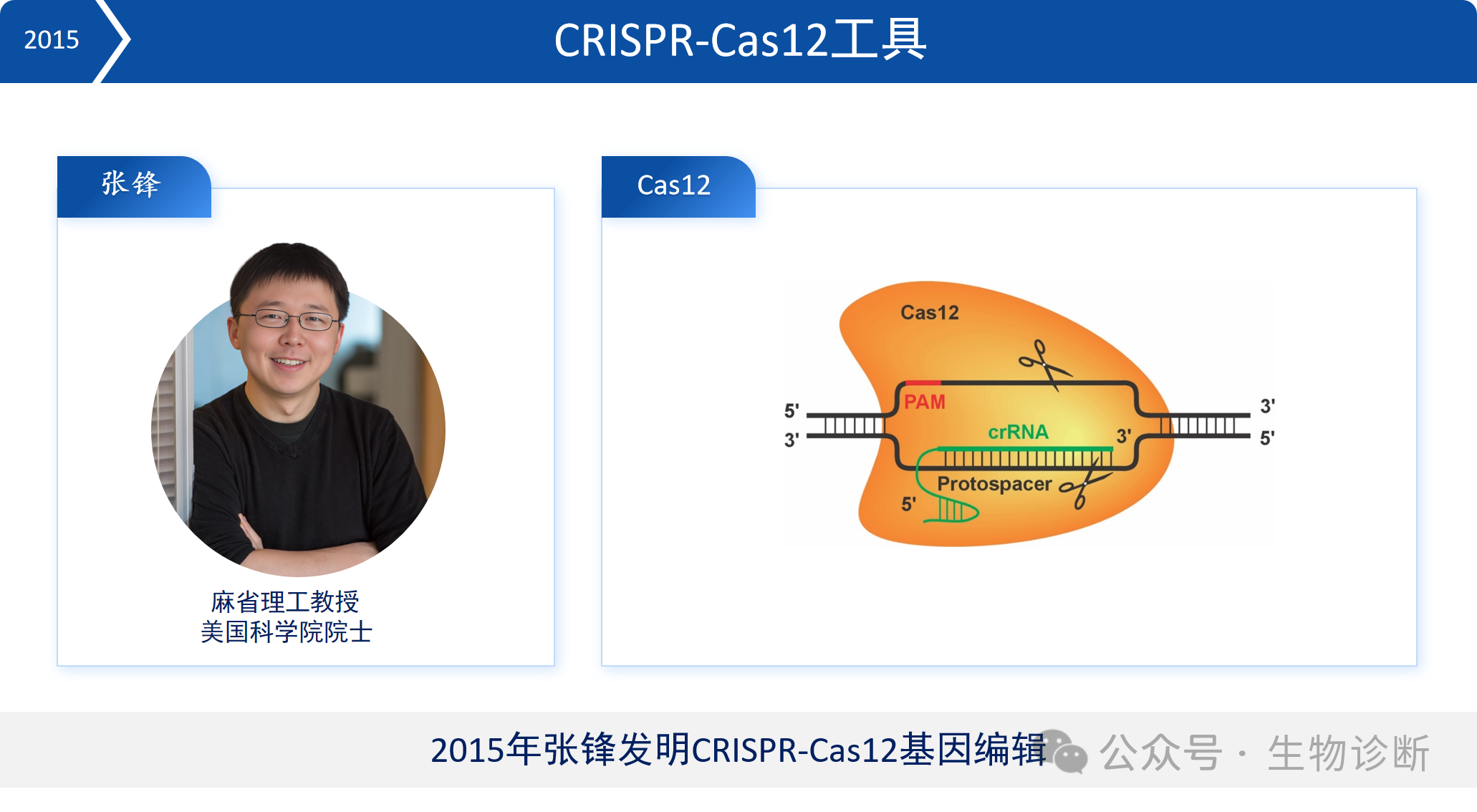
5.2 CRISPR-Cas12工具
2015年,张锋团队开发出CRISPR-Cas12基因编辑工具。与Cas9相比,Cas12识别的PAM序列位于DNA的5’端,且具有旁切活性,适用于基因编辑与基因检测。
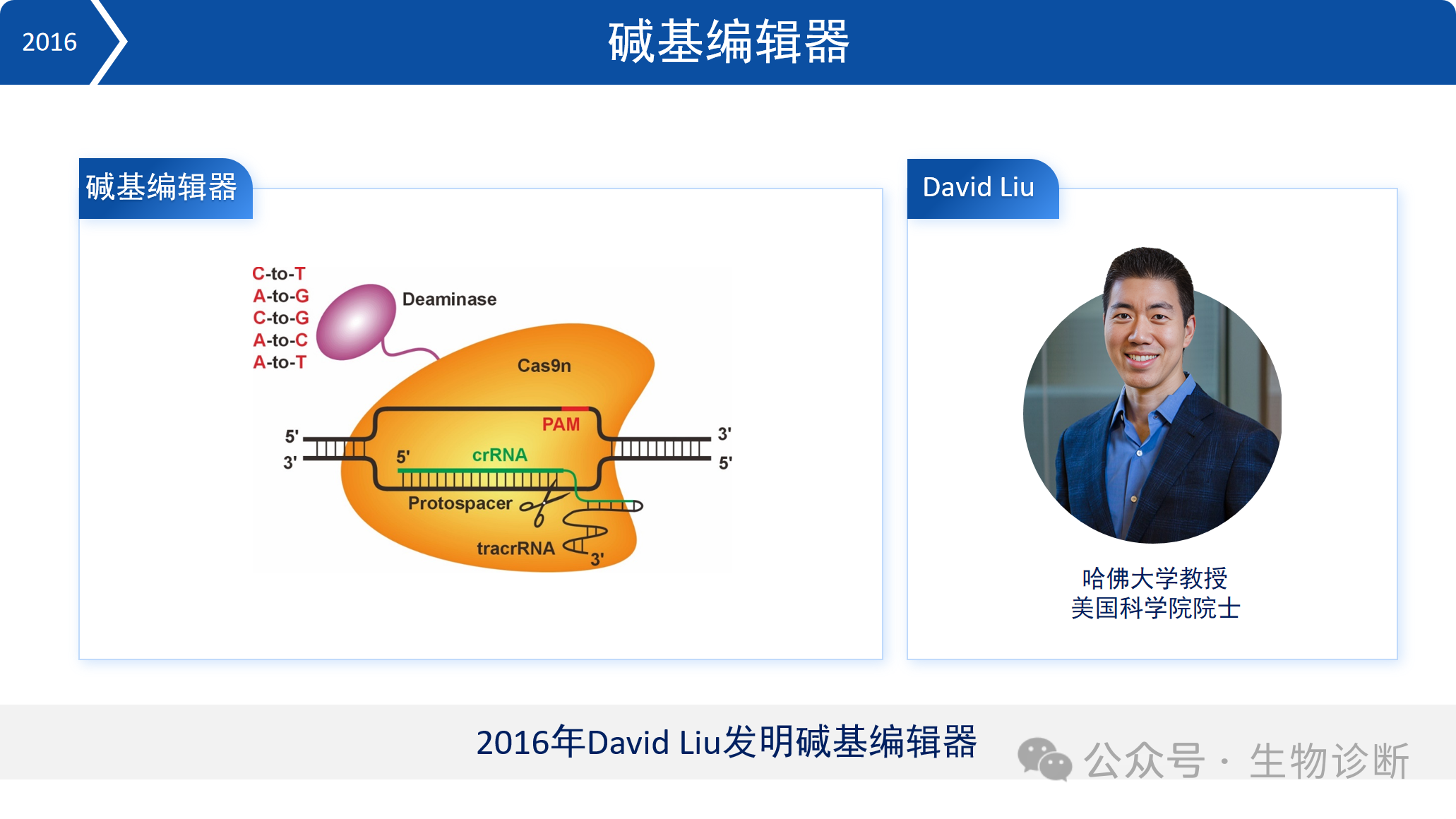
5.3 碱基编辑器
2016年,David Liu团队发明了碱基编辑器。该技术将Cas9蛋白改造为切口酶,连接脱氨酶,实现单碱基的精准编辑(C→T、A→G 等)。
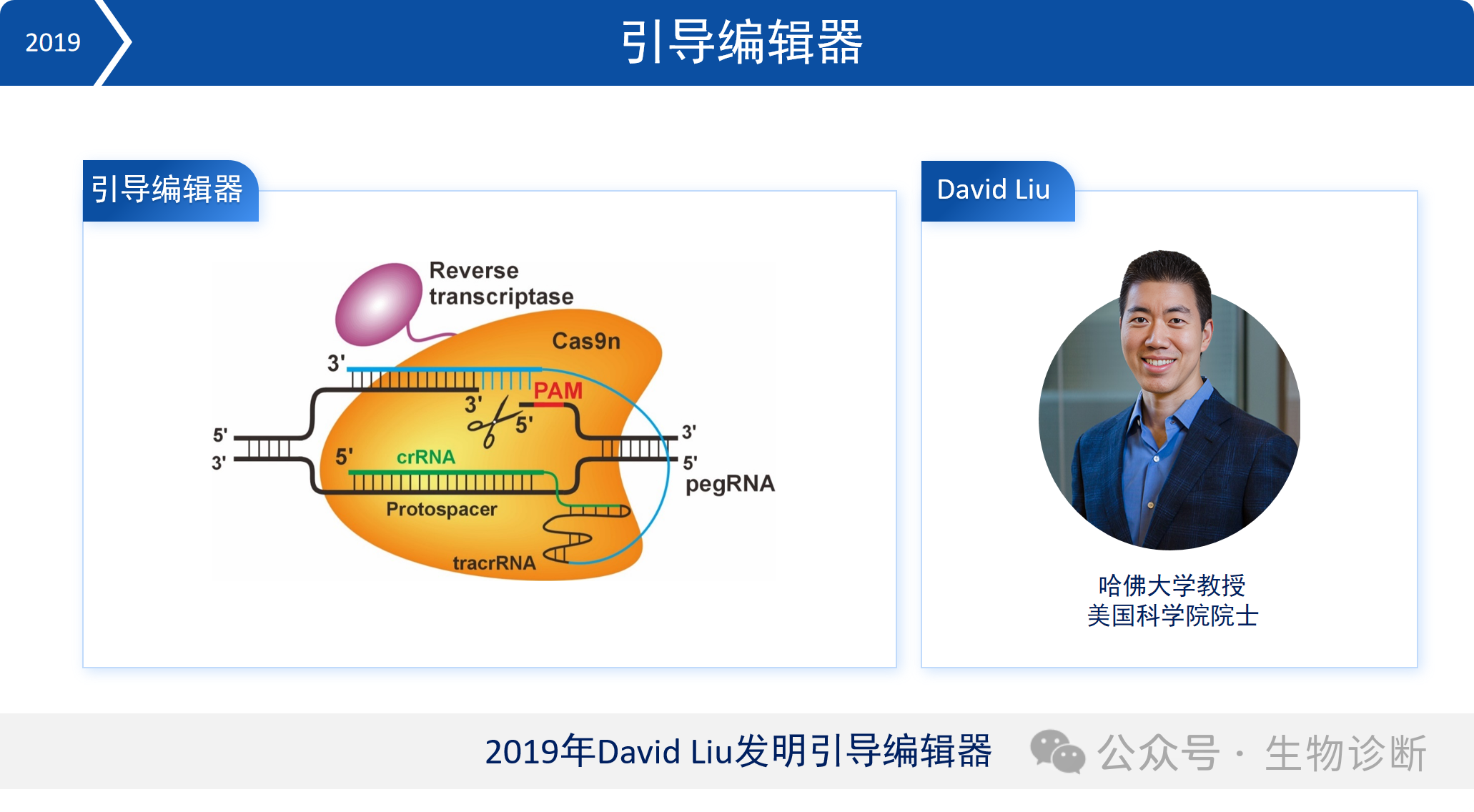
5.4 引导编辑器
2019年,David Liu团队进一步发明了引导编辑器。该技术通过在Cas9n蛋白上融合逆转录酶,利用工程化的引导RNA作为模板,实现了多种碱基的替换以及小片段的插入或删除。该技术无需依赖同源重组修复,相比传统方法在精准编辑方面效率更高,脱靶率更低。
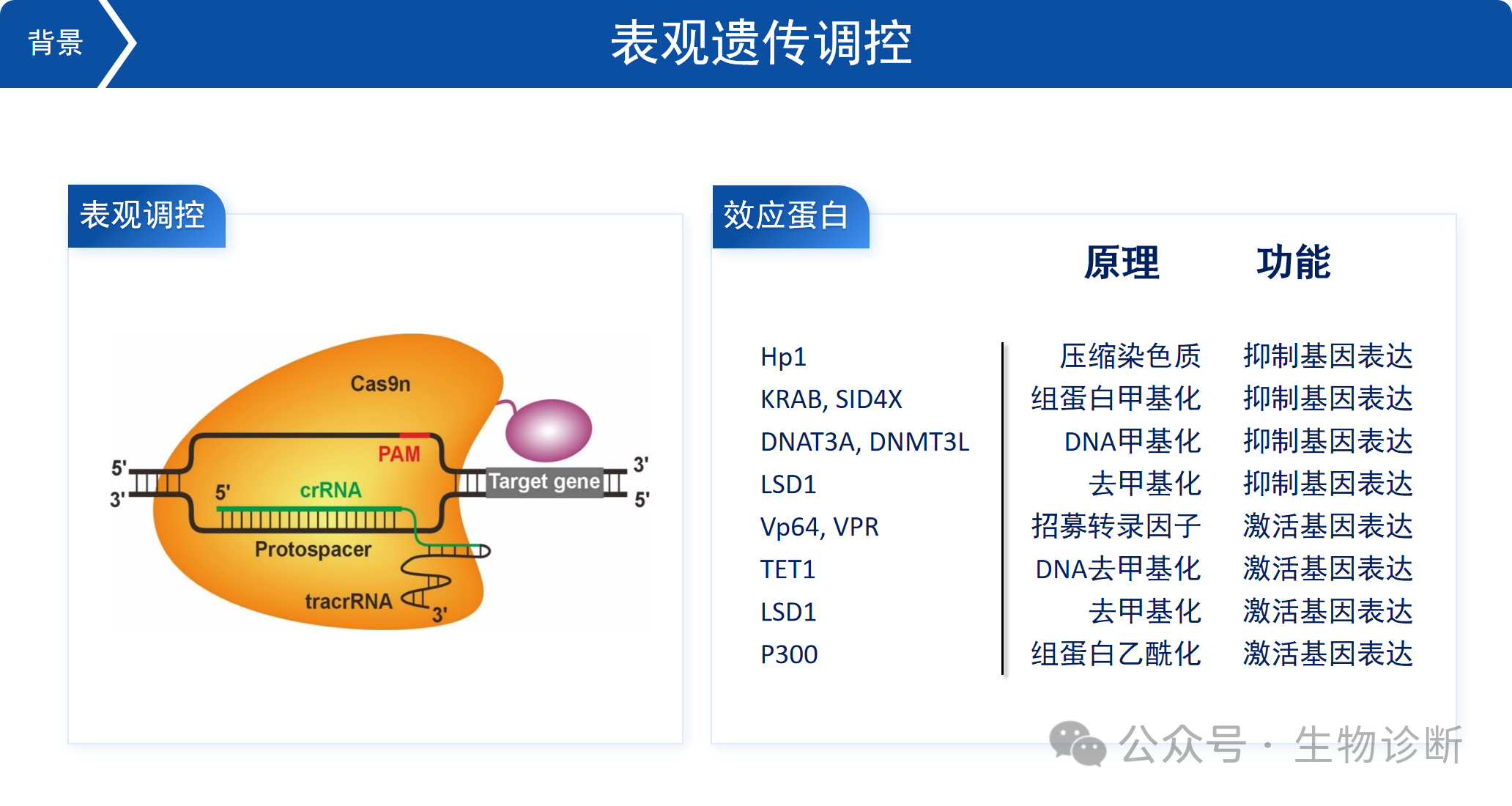
5.5 表观遗传调控
除了基因编辑,CRISPR系统还可用于表观遗传调控。通过将Cas9蛋白的切割活性去除,并连接效应蛋白,可改变DNA的甲基化或组蛋白的乙酰化状态,从而调控基因表达。
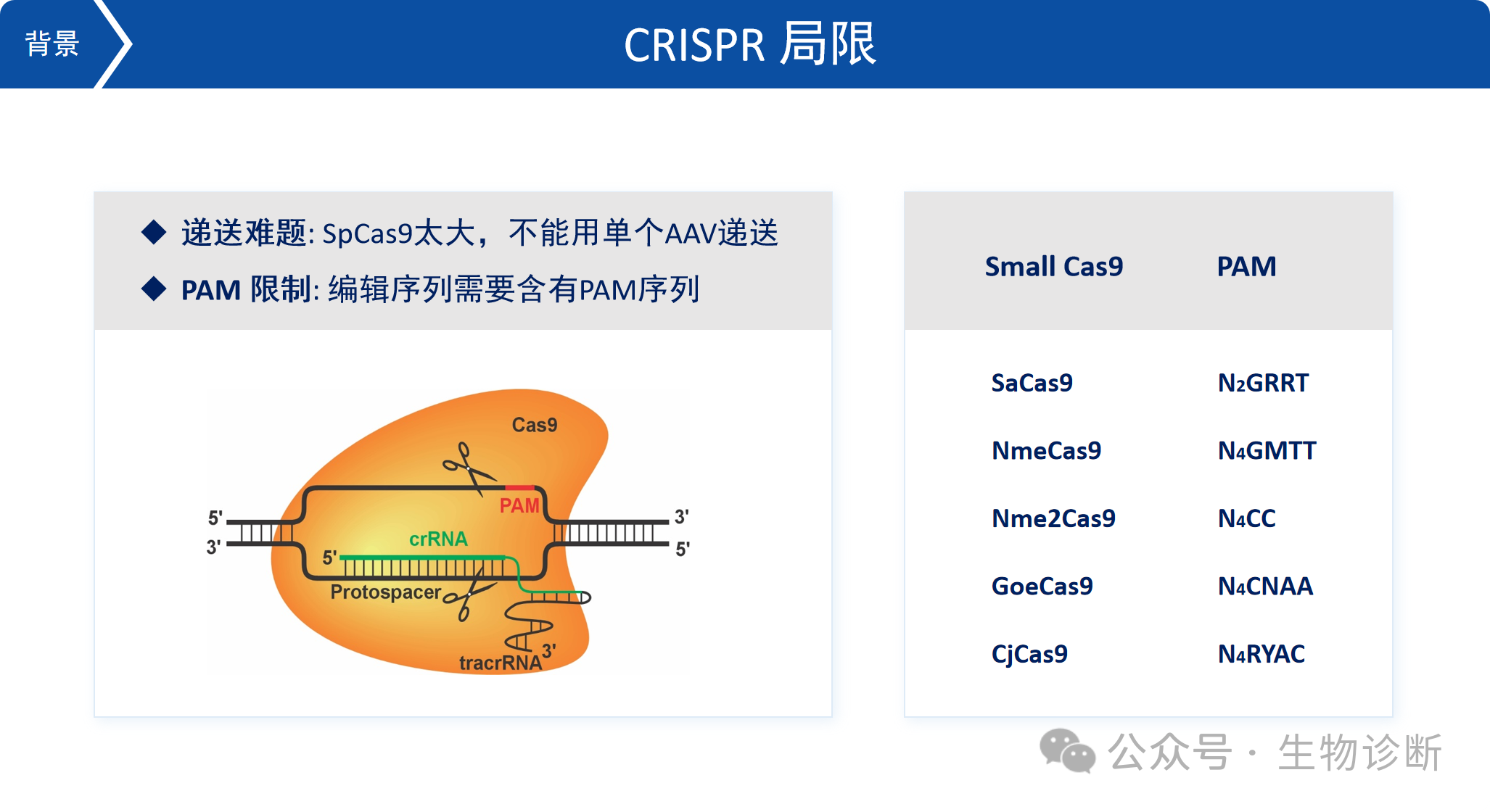
6. CRISPR局限
目前CRISPR技术仍存在以下局限:
递送难题:常用的SpCas9分子量较大,难以通过单个AAV载体递送至体内。
PAM限制:编辑序列需要包含特定的PAM序列,限制了可编辑位点的范围。
02
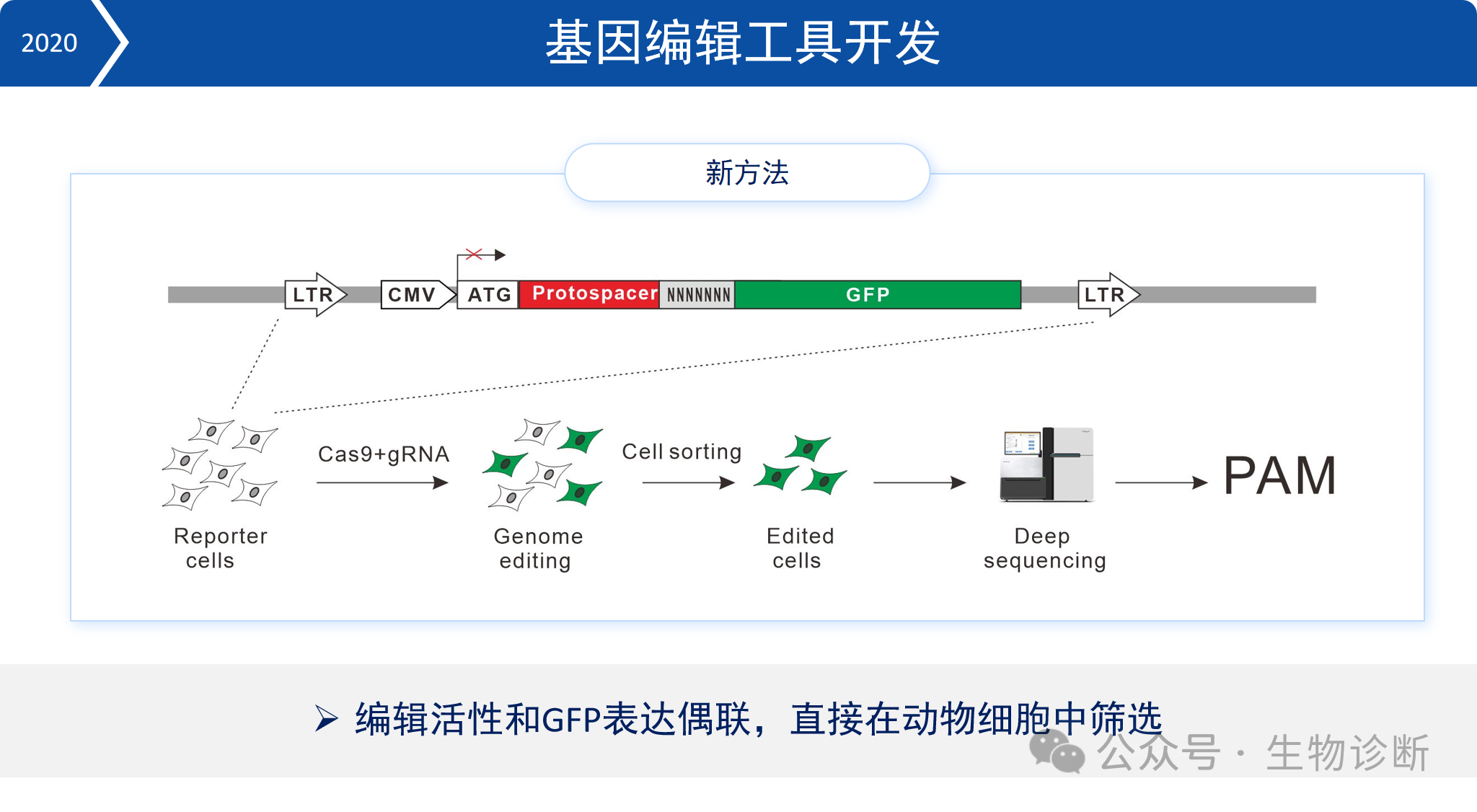
1. 新型Cas9筛选系统
为了开发更多小型、高效的Cas9蛋白,实验室建立了一套快速筛选系统:
报告基因构建:在起始密码子ATG与GFP序列间插入一段靶序列和8bp随机序列,形成移码突变,阻断GFP表达;
细胞系建立:将报告基因通过慢病毒整合到动物细胞基因组中,获得GFP无法正常表达的细胞系。
Cas9筛选:将待检测的Cas9蛋白转入细胞,若Cas9能切割靶序列,产生随机的插入缺失,以恢复GFP的开放阅读框,GFP将重新表达,则说明该Cas9具有编辑活性。
通过该系统,实验室成功筛选出多个具有编辑活性的小型Cas9蛋白。
2. 新型 Cas9 工具开发
2.1小型 Cas9 工具
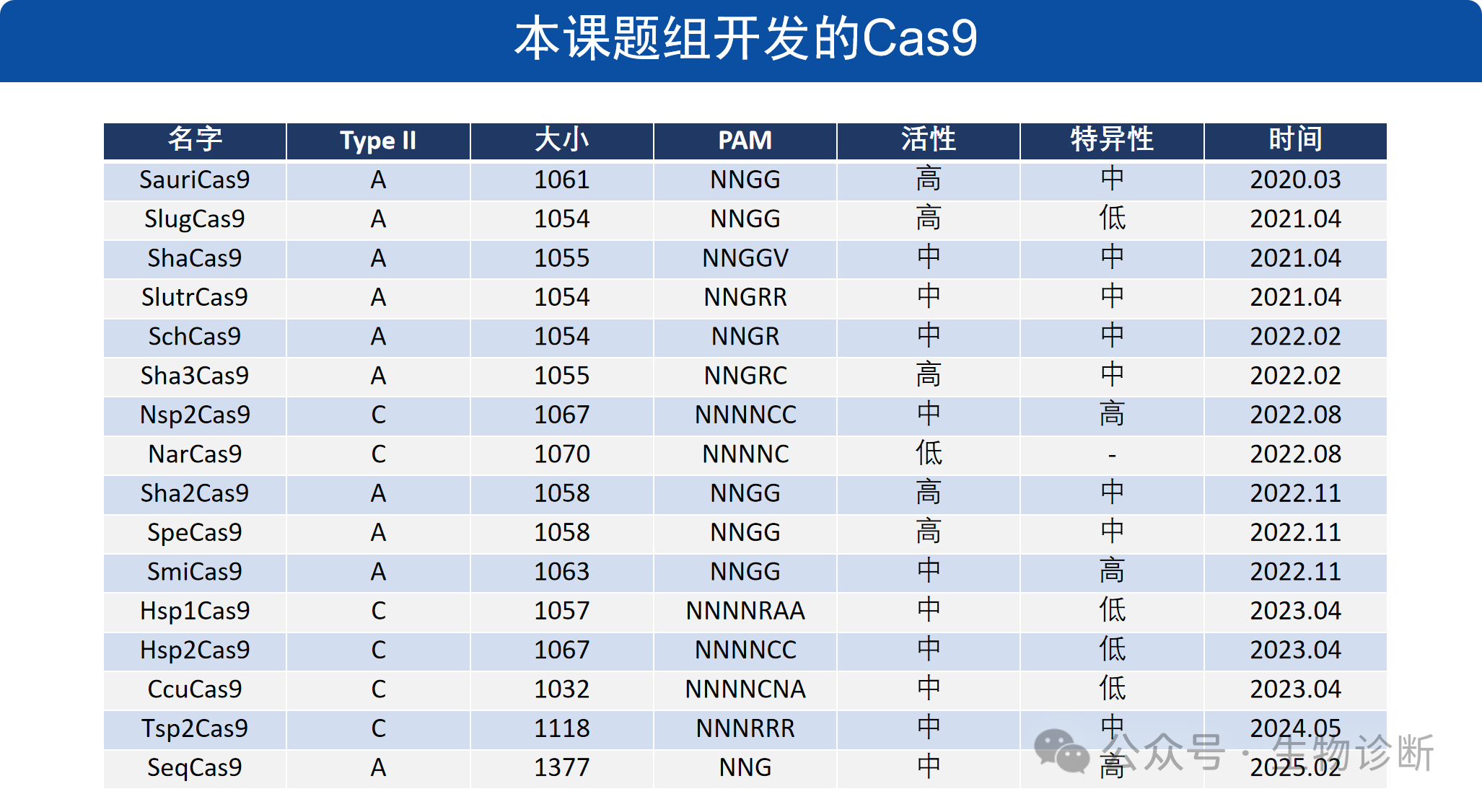
本课题组通过上述筛选系统,开发了一系列小型 Cas9 工具,核心成果包括:
(1)SauriCas9:活性与SaCas9相当、编辑范围与SpCas9一样,它识别简单的NNGG PAM,且大小仅1061个氨基酸,足够紧凑,可以包装到AAV中进行在体基因治疗。
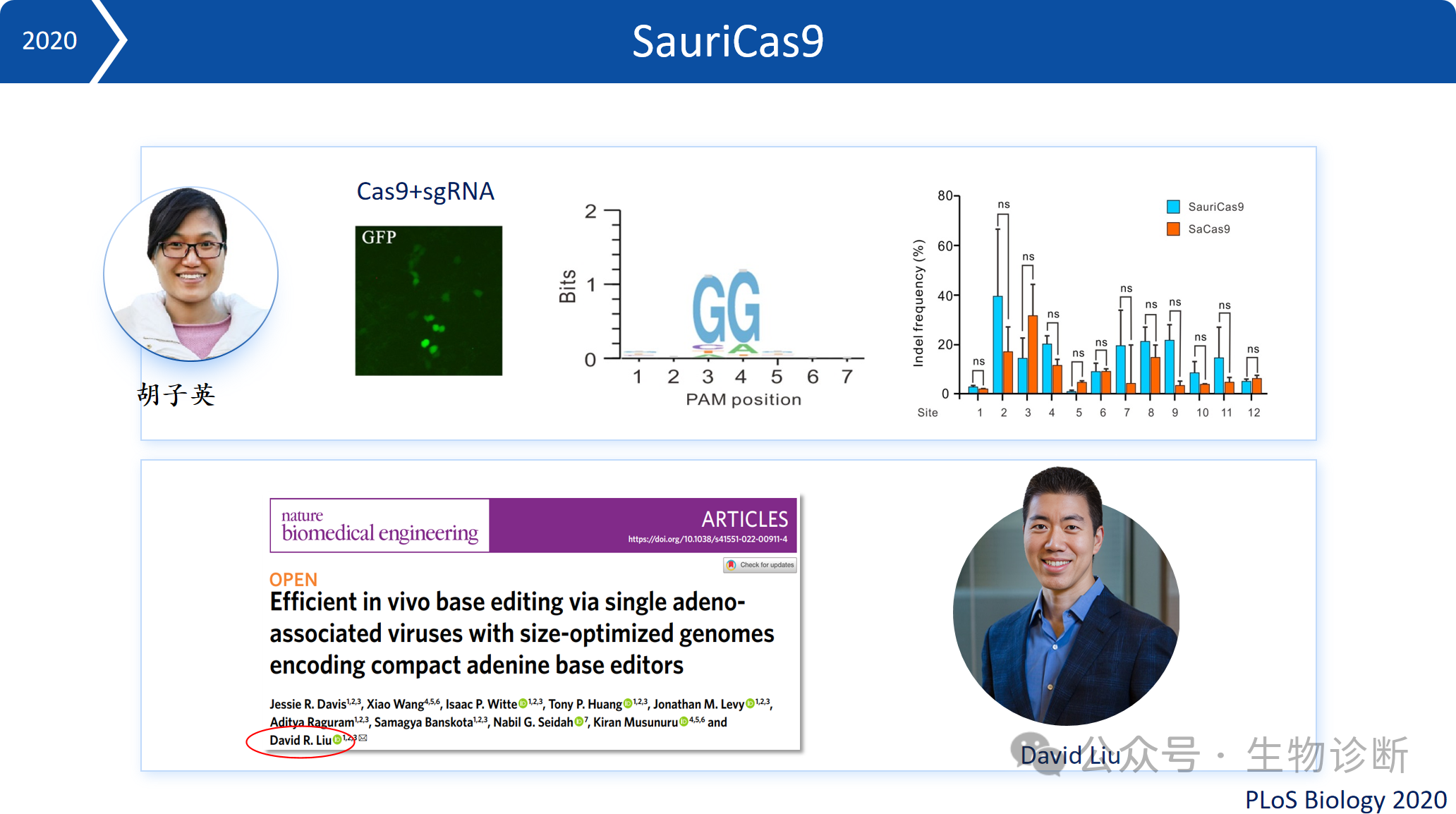
(2)SlugCas9:识别简单的NNGG PAM序列,其具有活性高、精准性高、编辑范围广、尺寸小等优点。

(3)其他工具:包括 ShaCas9、SchCas9、Tsp2Cas9 等,覆盖不同 PAM 序列,满足多样化编辑需求。
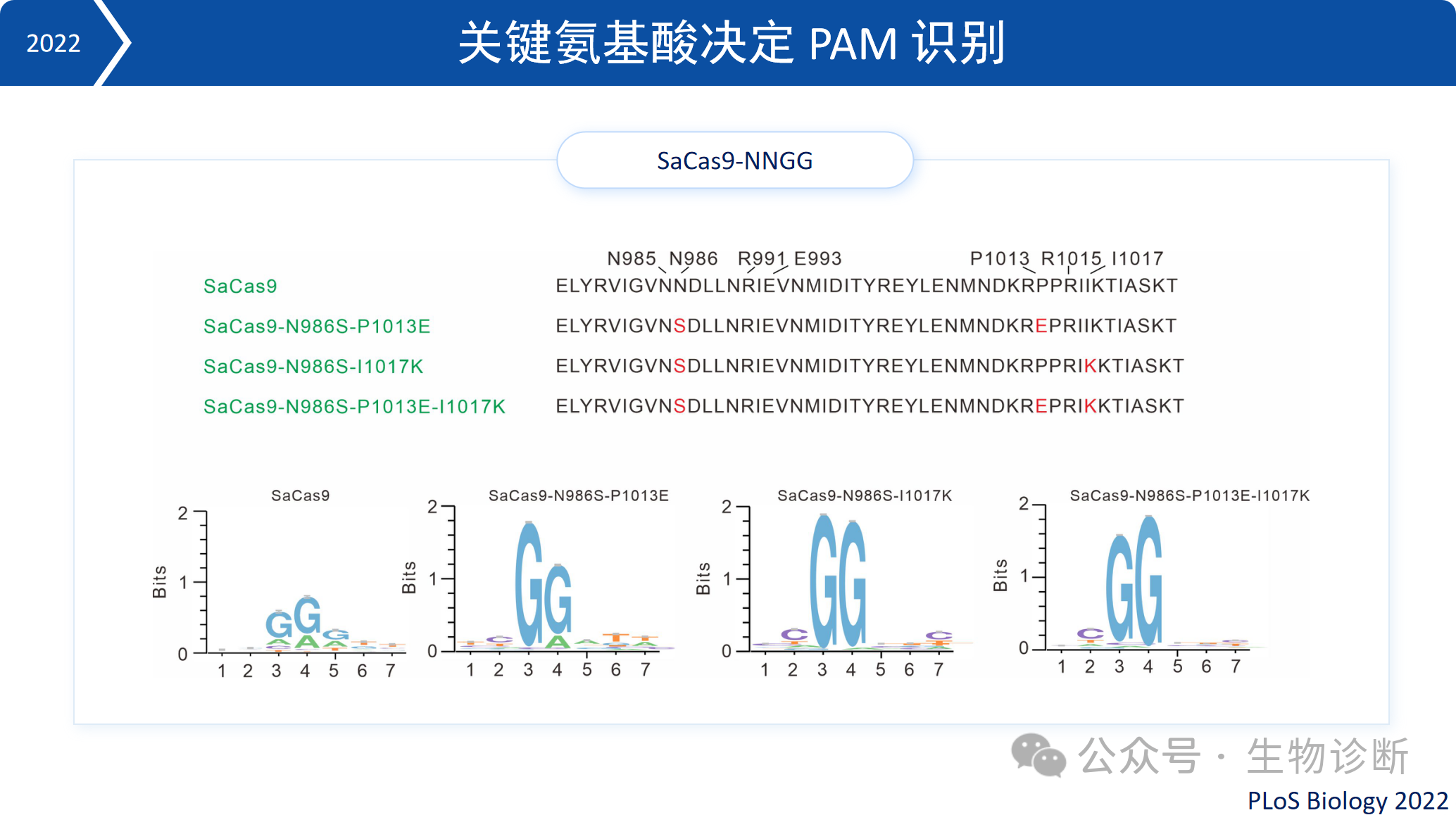
2.2 PAM 识别机制与改造
研究发现,Cas9蛋白PAM识别结构域中的关键氨基酸决定了其PAM特异性。例如,含有S、E、K等氨基酸组合的Cas9倾向于识别“GG”PAM。将SaCas9的特定氨基酸替换后,其识别的PAM序列从NNGRRT变成NNGG。
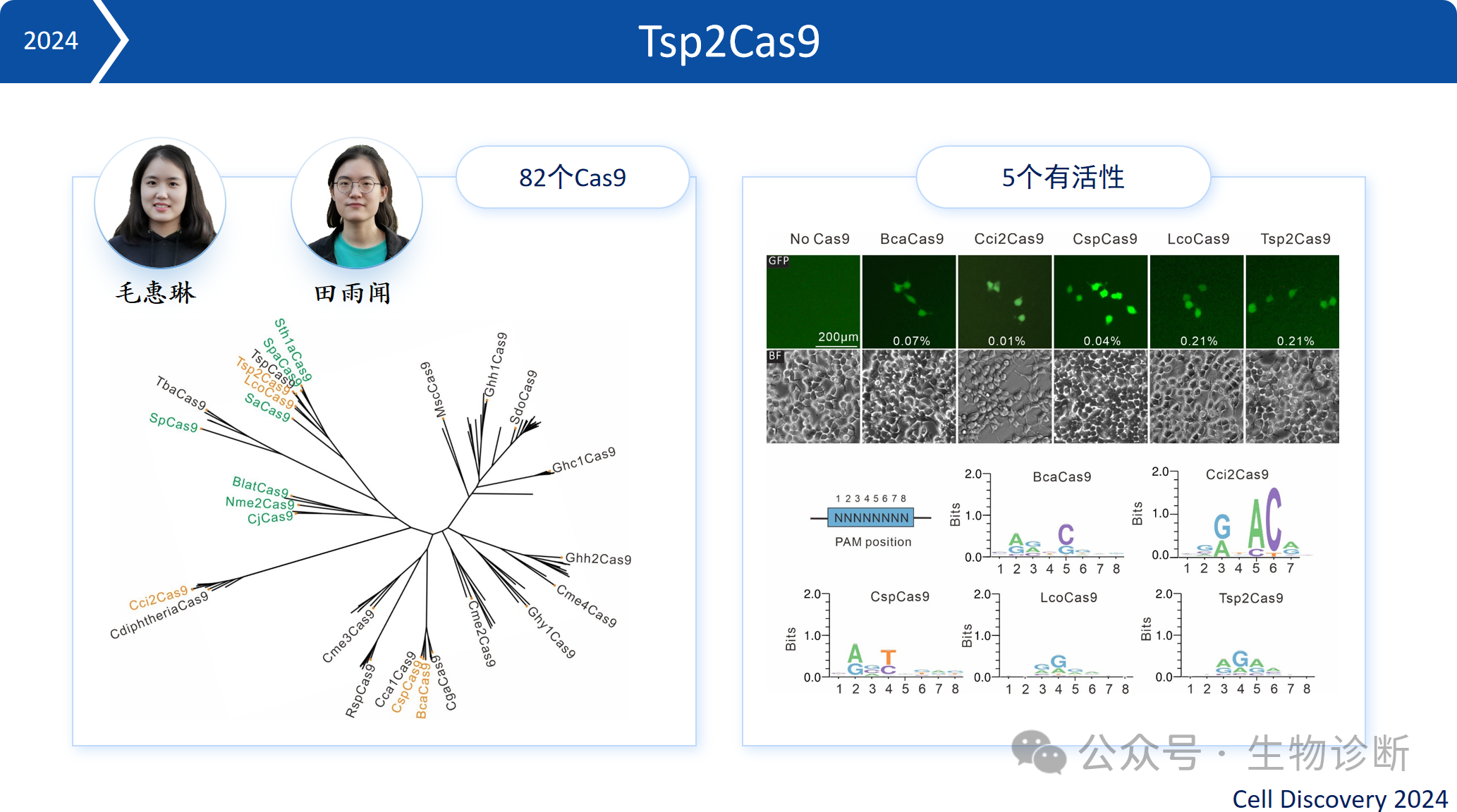
2.3 Tsp2Cas9
通过对82个Cas9蛋白进行筛选,筛选出5个具有活性的蛋白,其中Tsp2Cas9活性较高,可开发为基因编辑工具。该研究表明,自然界中具有编辑活性的Cas9蛋白比例较低,需要通过高效筛选系统进行鉴定。
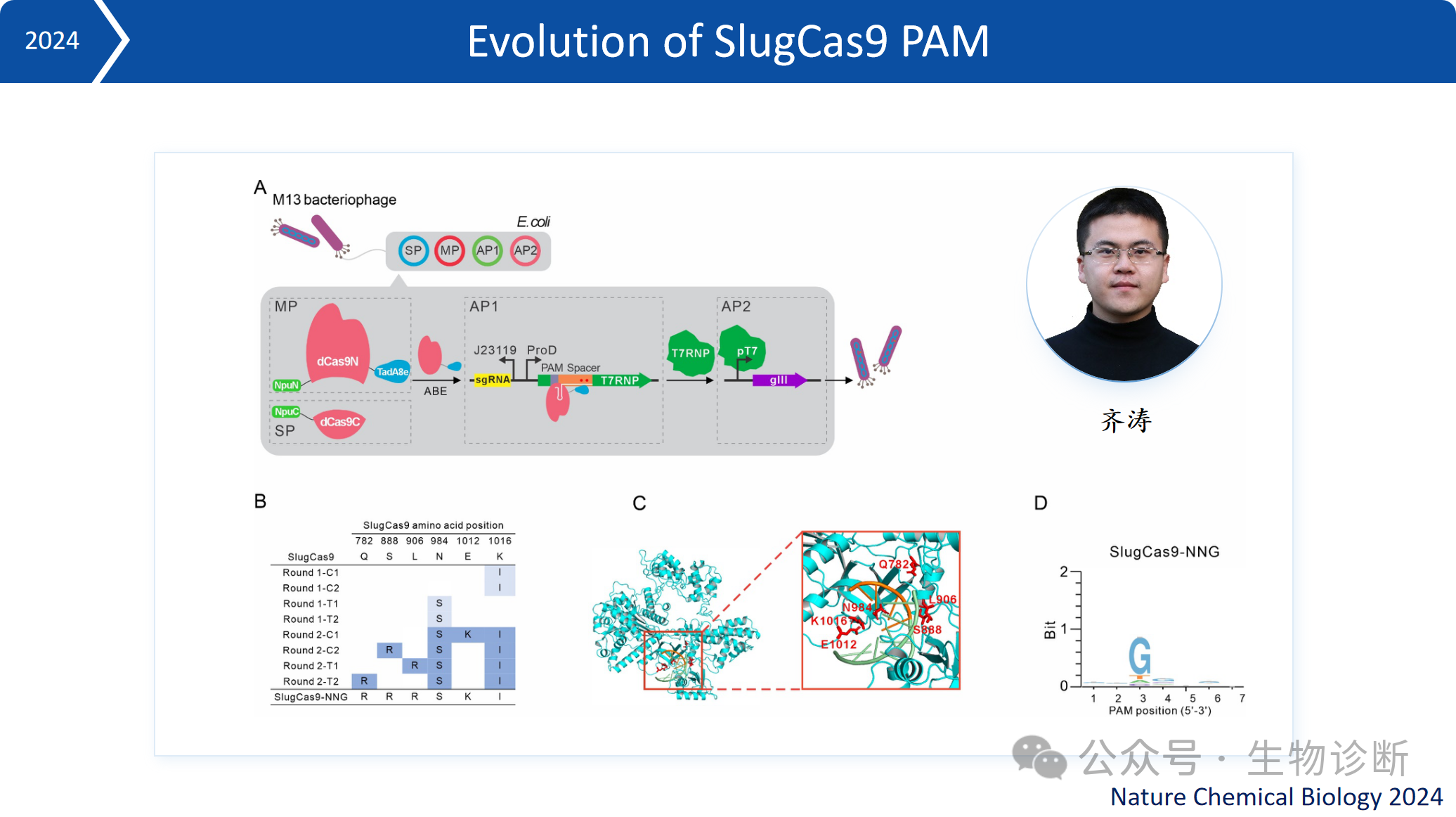
2.4 SlugCas9进化
为进一步优化工具性能,本实验室采用噬菌体辅助进化技术,对SlugCas9进行定向进化,可识别 NNG 型 PAM,进一步扩大了编辑位点覆盖范围。
3. Cas12系列工具开发
除了Cas9,本实验室还致力于Cas12系列工具的开发,可用于基因检测。
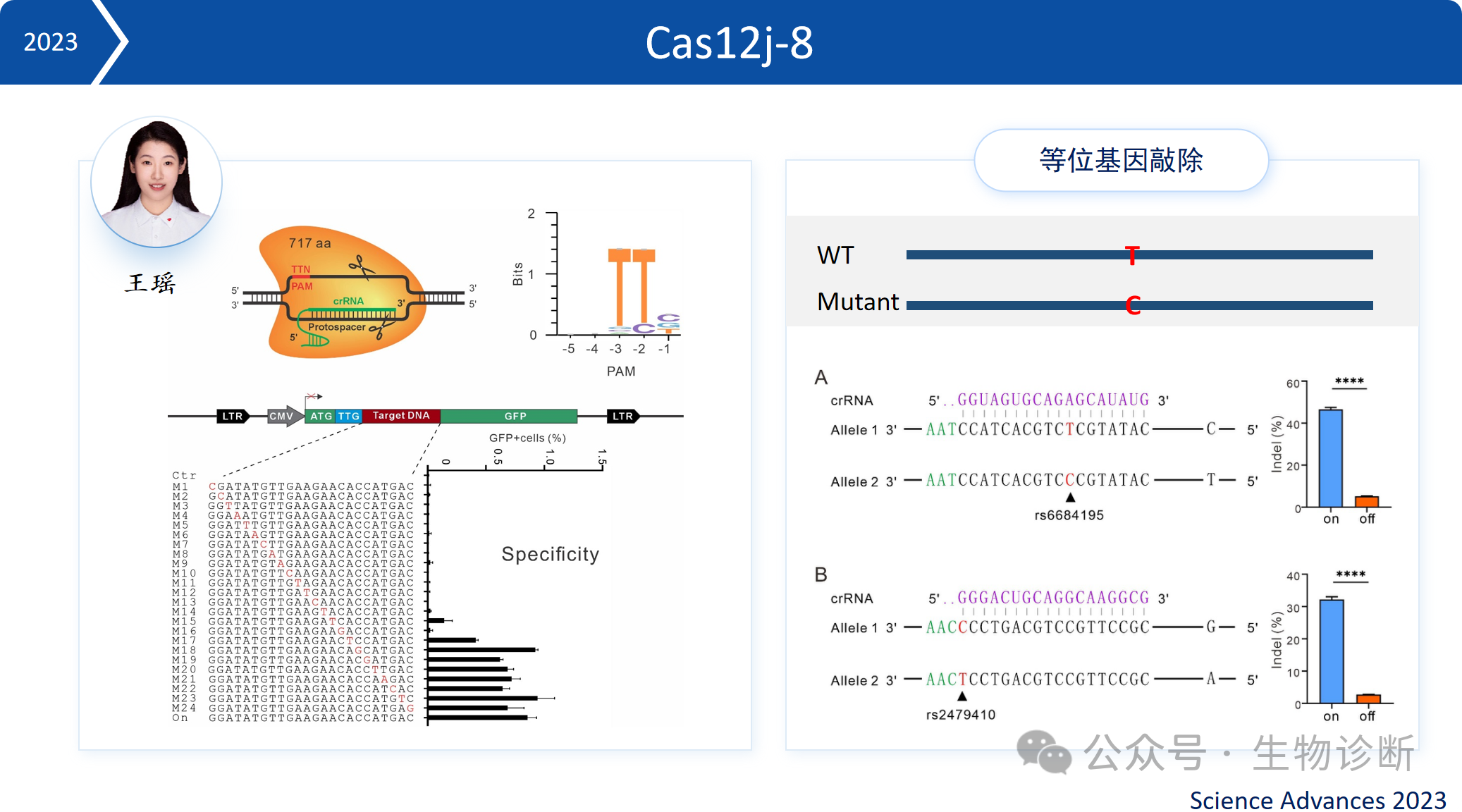
3.1 Cas12j-8
特性:仅 717 个氨基酸,PAM 序列为 TTN,特异性高
应用:可实现等位基因敲除,针对显性突变疾病(如部分遗传病),敲除突变拷贝即可达到治疗效果。
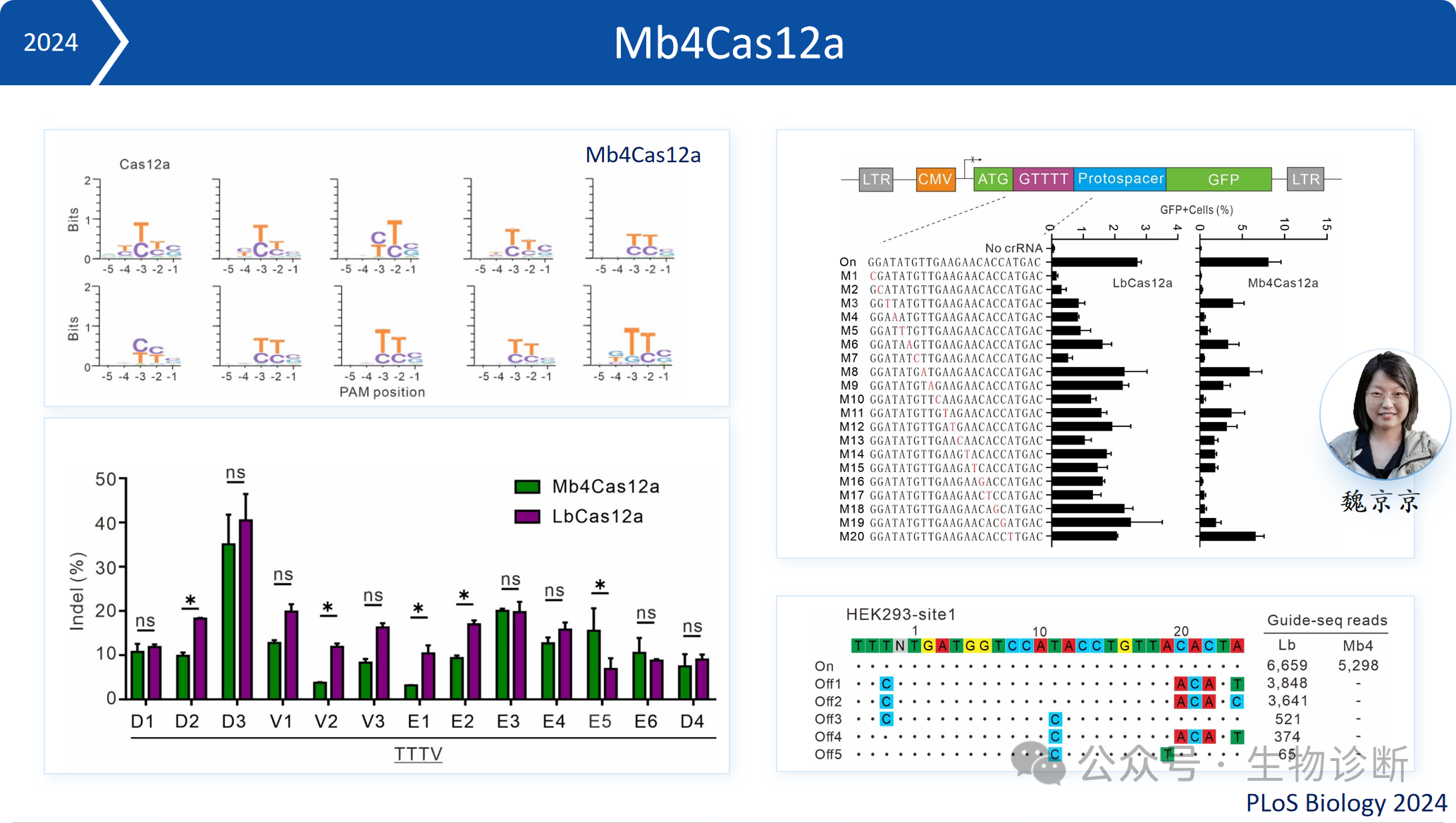
3.2 Mb4Cas12a
Mb4Cas12a,其识别的PAM序列为TTN,与经典的LbCas12a相比,可编辑位点范围更大,脱靶率更低。
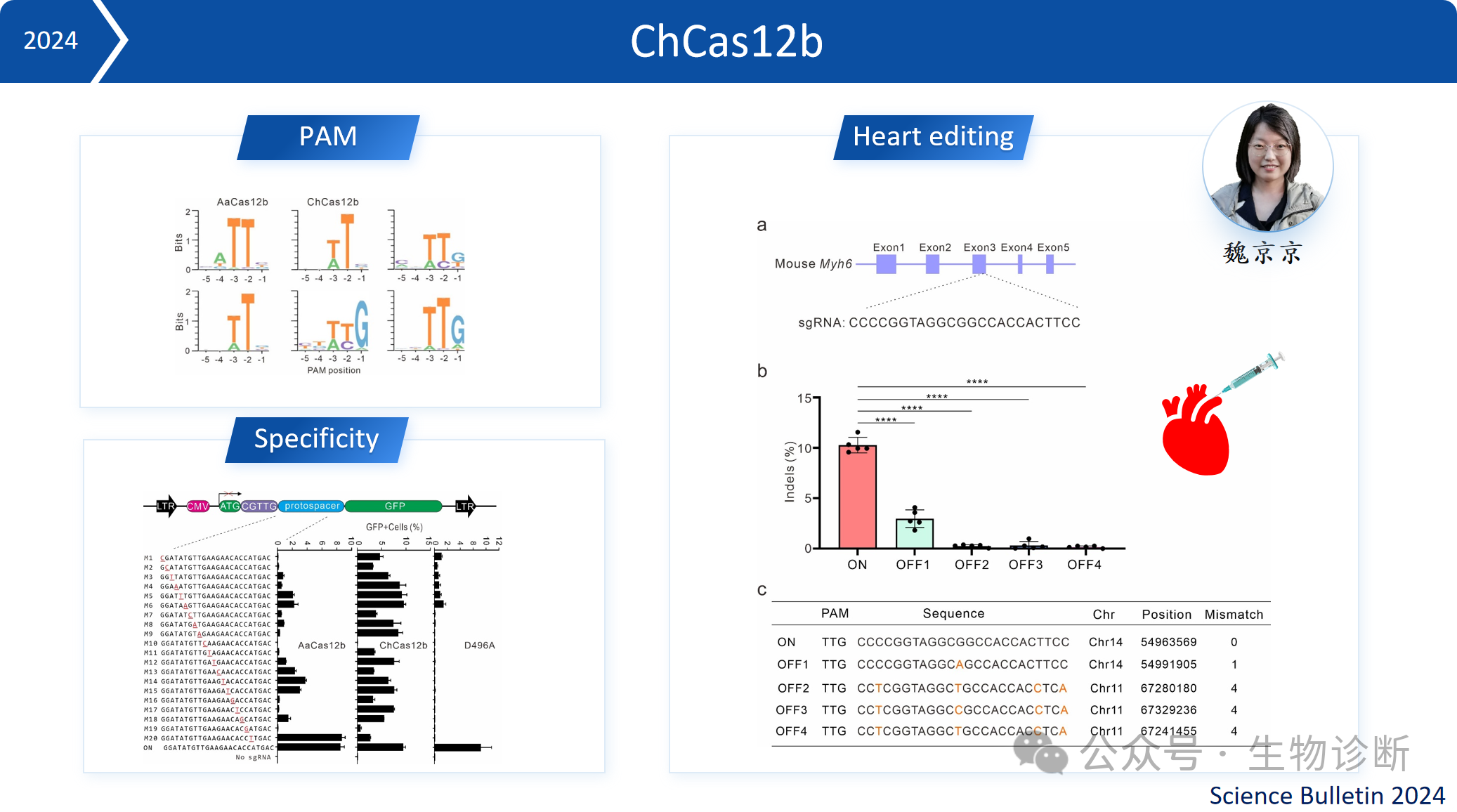
3.3 ChCas12b
ChCas12b能够识别WTN PAM(W=T或A)序列,这使得它们能够靶向更多的基因组区域。ChCas12b将其包装到腺相关病毒(AAV)传递,实现了在小鼠心脏中的基因组编辑。
03
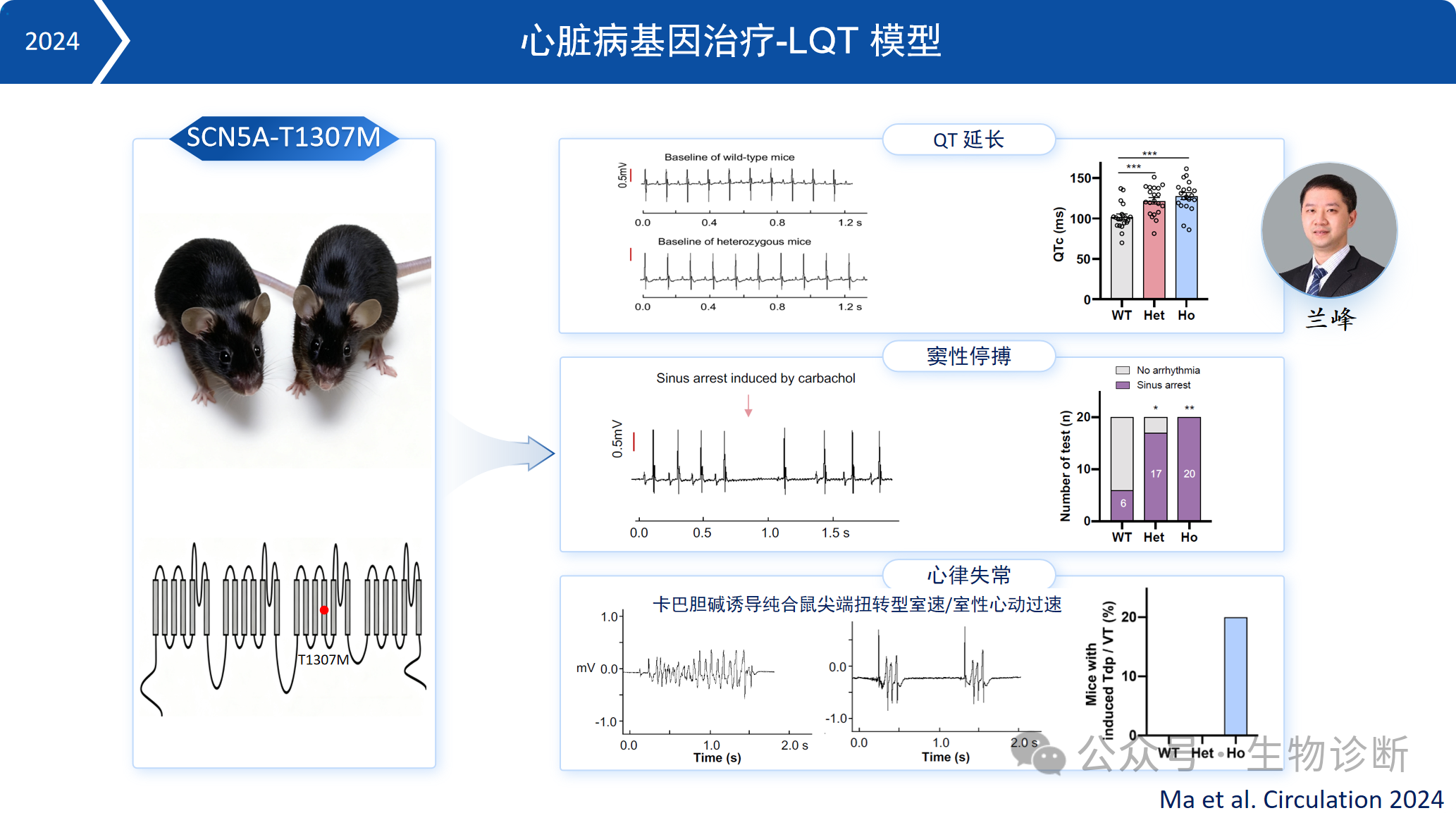
1. 心脏病基因治疗-LQT模型
通过建立SCN5A-T1307M突变小鼠模型,模拟人类LQT3综合征。模型小鼠表现出典型的心电图QT间期延长,并在药物(卡巴胆碱)诱导下出现心律失常和窦性停搏。
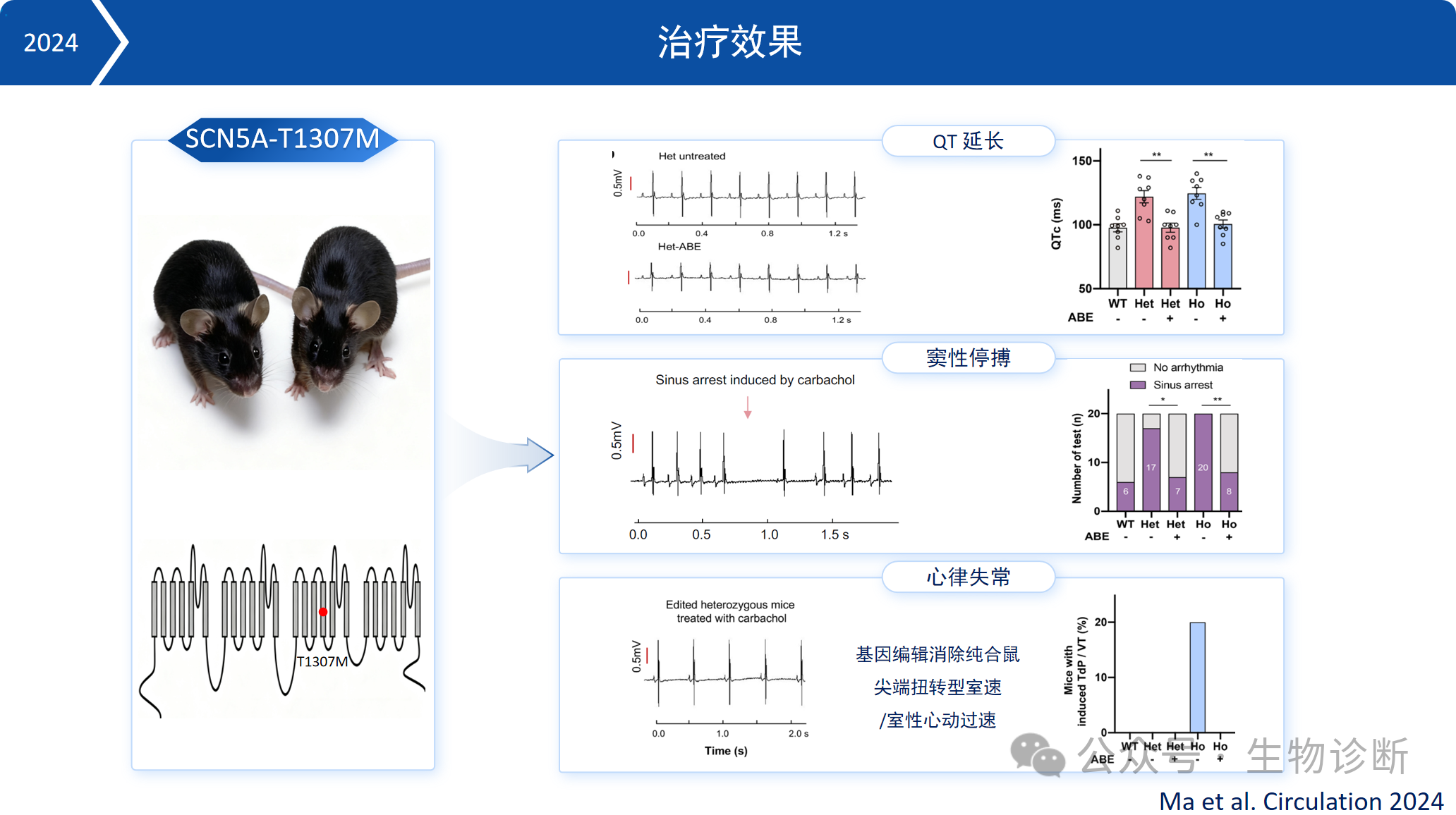
2. LQT治疗
使用碱基编辑器纠正SCN5A-T1307M突变,编辑效率可达70%左右。基因治疗后,突变小鼠的心电图指标恢复正常,卡巴胆碱诱导的心律失常发生率显著降低,纯合子小鼠的严重心律失常症状完全消失。
3. 孤儿药认证
Fisrt-in-Class 心脏碱基编辑药物RZ-g001BE获得美国FDA孤儿药认定,为LQT综合征的基因治疗提供了新的临床方案。该项目还入选“2024年度中国心血管病基础医学领域十大研究进展”。

04
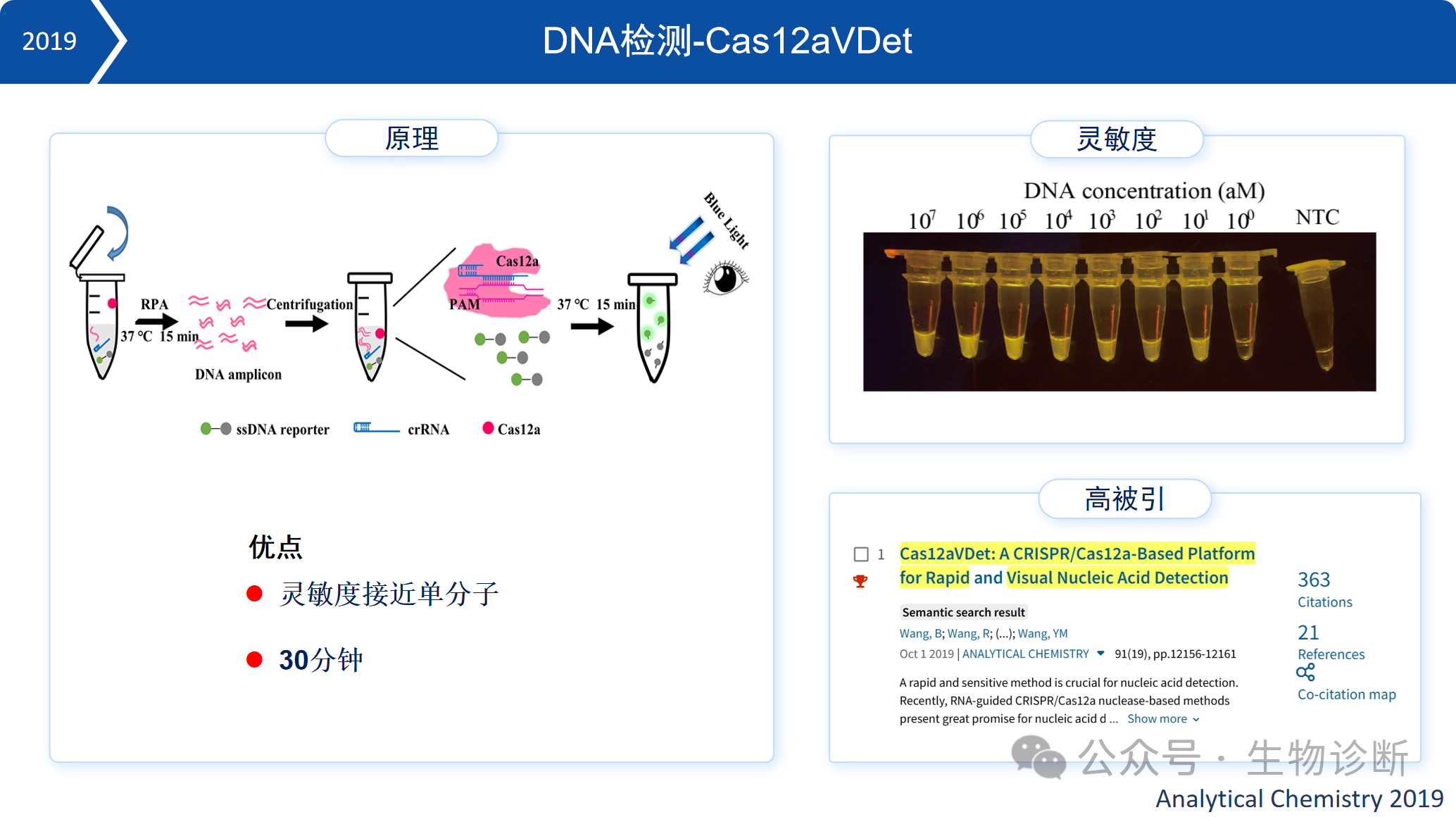
1. DNA检测-Cas12aVDet
2019年,本实验室开发出基于Cas12a的DNA检测技术Cas12aVDet。该技术通过优化反应体系,实现了等温扩增与Cas12a旁切检测的一体化,灵敏度接近单分子水平,可在30分钟内完成检测。
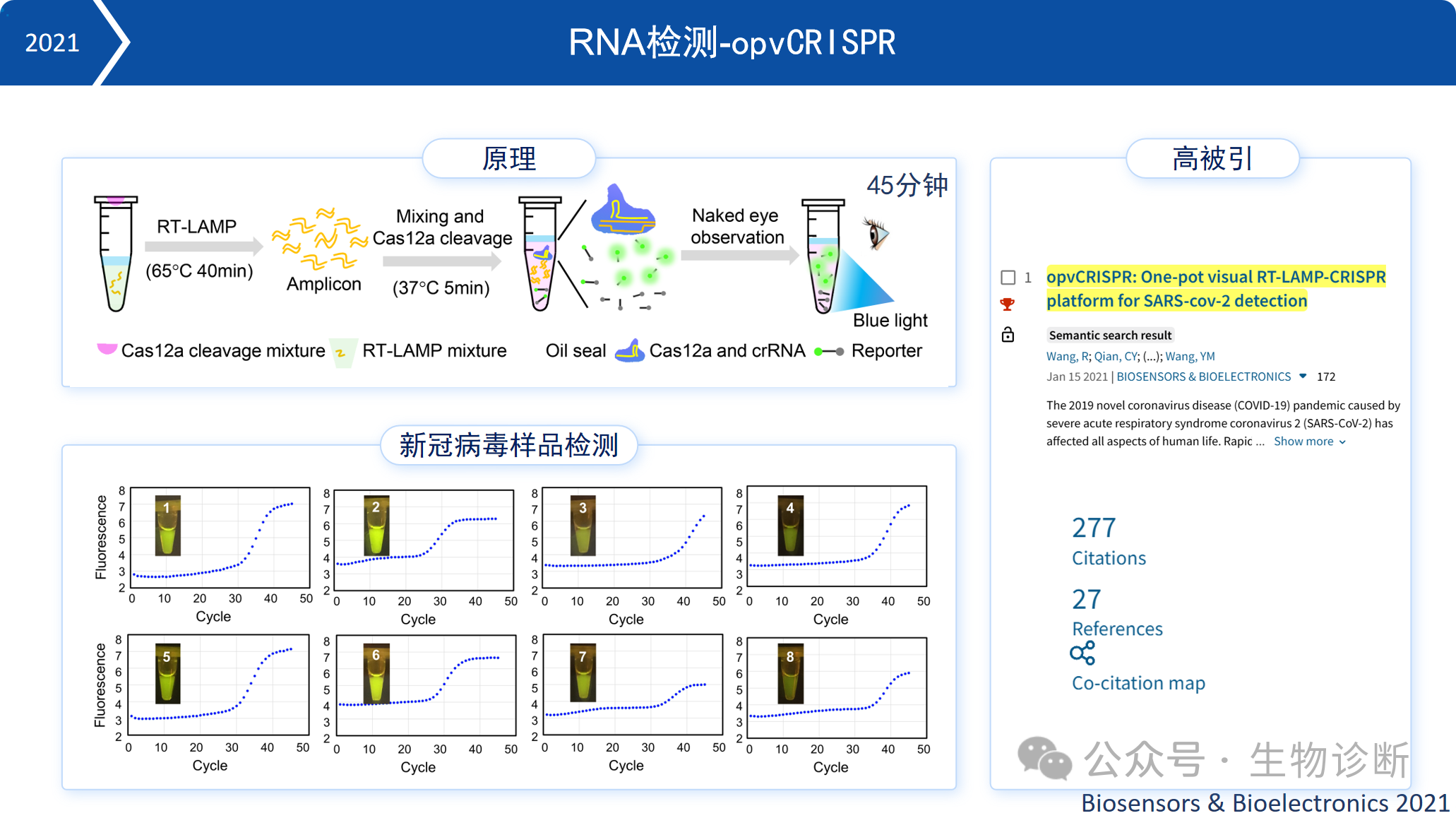
2. RNA检测-opvCRISPR
2021年,本实验室进一步开发出RNA检测技术opvCRISPR。该技术结合RT-LAMP等温扩增与Cas12a旁切检测,可在45分钟内完成RNA检测,灵敏度高,操作简便。相关论文已成为高被引文章。
05
课题组通过建立高效的筛选与进化平台,成功开发了一系列具有小尺寸、高活性、高特异性及宽松PAM识别能力的新型CRISPR-Cas基因编辑工具,并验证了其在遗传性疾病基因治疗和快速病原检测中的有效性与应用潜力。未来,团队将继续优化工具性能,拓展其应用范围,并推动更多基因编辑疗法走向临床,造福患者。





发表评论 取消回复