吐露港生物王金博士报告:《基于CRISPR的下一代分子诊断技术: 从实验室到临床》


2025年6月7日,由中国医药生物技术协会生物诊断技术分会主办,首期“生物诊断前沿技术专题会”在北京亦庄生物医药园召开。专题会聚焦《CRISPR诊断技术的创新与转化》。
生物诊断公众号将对各专家汇报内容进行汇编整理,供关注CRISPR诊断技术的业内同仁学习参考。
本期分享吐露港生物王金博士报告:《基于CRISPR的下一代分子诊断技术: 从实验室到临床》。

基于CRISPR的下一代分子诊断技术:从实验室到临床新型CRISPR分子诊断方法开发

本次报告将重点探讨基于CRISPR技术的下一代分子诊断技术从实验室研究到临床应用的发展路径。
众所周知,CRISPR技术曾荣获诺贝尔奖,但需要明确的是,该奖项主要表彰其在基因编辑领域的突破性贡献,由Emmanuelle Charpentier和Jennifer A. Doudna两位科学家共同获得。

CRISPR诊断技术同样备受学术界关注。2018年,《Science》杂志将其誉为"下一代诊断技术",这主要归功于其快速、精准和便捷的技术特性。Jennifer Doudna在其Nobel Lecture中,除阐述CRISPR在基因编辑领域的应用外,特别强调了CRISPR诊断技术的广阔应用前景。
此外,《Nature》杂志在2022年将其评选为年度最值得关注的七大技术之一,与蛋白质结构预测(诺奖成果)及量子模拟等技术并列。
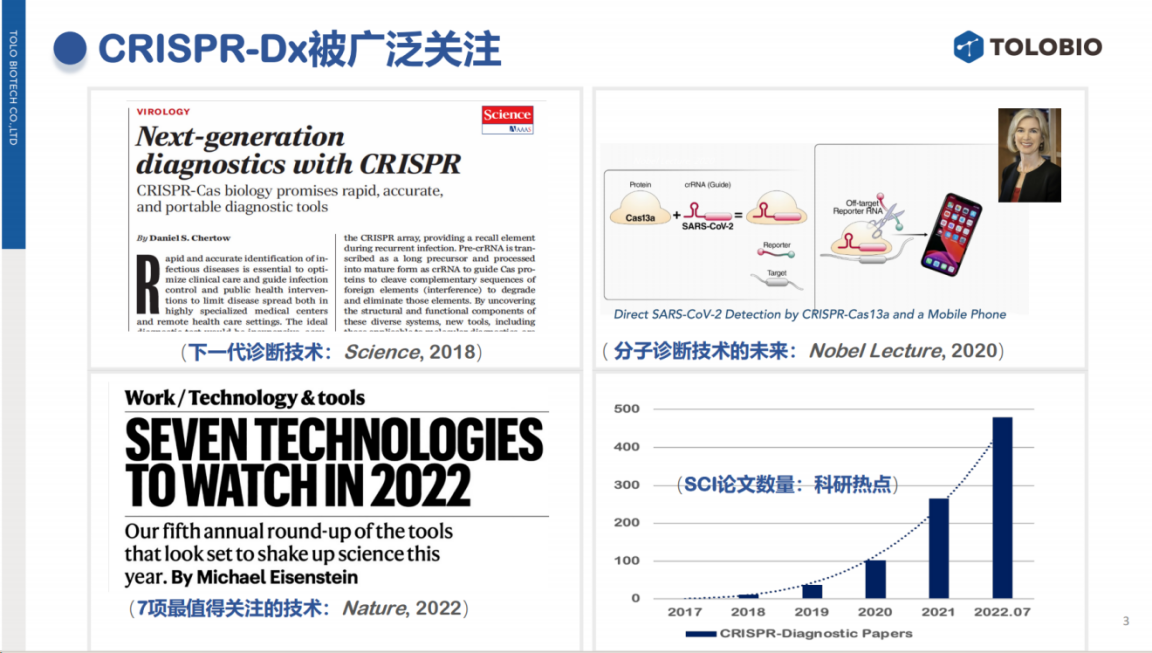
从科研发展态势来看,CRISPR技术已成为当前研究热点。
数据显示,2017-2018年间相关论文年发表量仅几篇,而至2022-2023年,包括研究论文和综述在内的年发表量已突破1000篇。
这些研究成果广泛发表于《Cell》《Nature》《Science》等顶级期刊,以及《新英格兰医学杂志》等权威刊物。仅2024年,《Nature》子刊就刊登了众多相关论文,充分体现了该领域的研究热度。


CRISPR技术在诊断领域的应用主要体现为靶标检测功能,其检测范围涵盖核酸和非核酸两大类。
核酸靶标包括DNA和RNA,适用于细菌、病毒、遗传病和肿瘤等多种检测场景;
非核酸靶标则涉及离子、蛋白质等物质。
从理论上讲,CRISPR技术可实现对所有类型靶标的检测。

该技术的核心原理源于其精准的靶向识别能力,常被誉为"上帝的手术刀"。
在向导RNA的引导下,CRISPR系统能够特异性识别目标序列并进行精确切割。研究发现,某些Cas蛋白(如Cas12和Cas13)除具备靶向切割活性外,还具有反式切割特性:Cas12在识别DNA靶标后,可非特异性切割体系中的所有单链DNA;Cas13则能在识别RNA靶标后,非特异性切割任意RNA序列。这种旁路切割活性为诊断应用提供了重要基础。
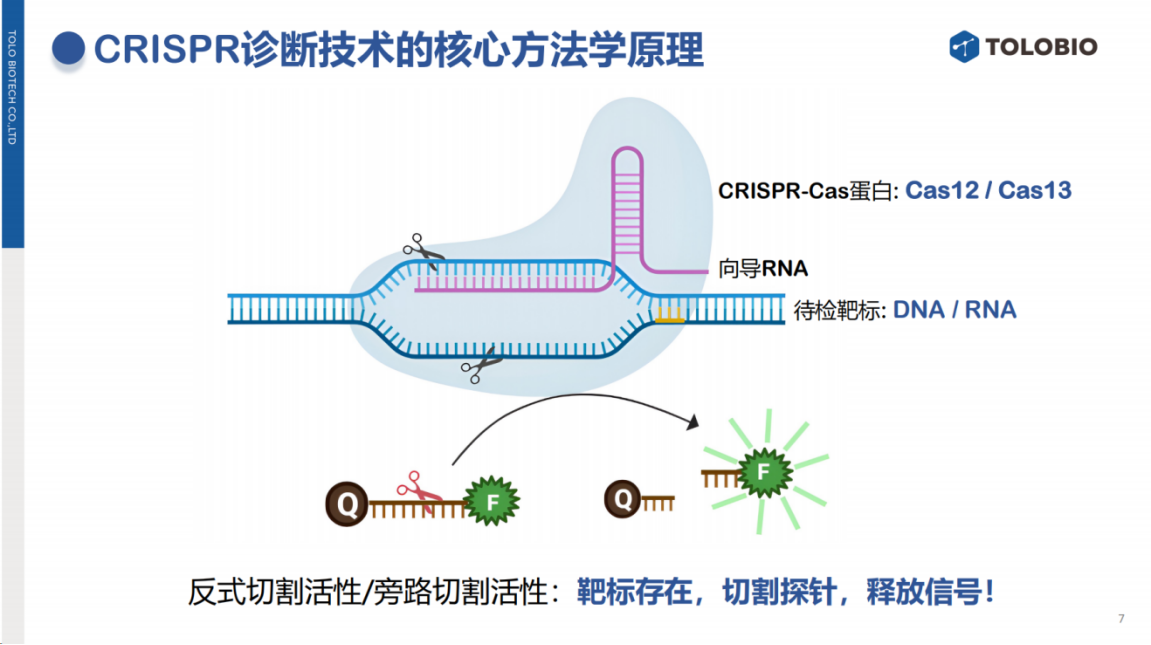
CRISPR诊断技术具有以下显著优势:
高特异性:假阳性率极低
高灵敏度:结合扩增技术可达阿摩尔级(单分子水平)
操作简便:恒温反应,无需复杂温控
设备兼容性强:支持荧光、电化学、比色法等多种检测方式
可集成化:可与胶体金试纸条等技术结合

特别值得关注的是,与常规胶体金检测相比,CRISPR诊断技术的灵敏度和特异性可提升数十至上百倍,达到与PCR技术相当的检测水平。
这种兼具操作简便性和检测准确性的特点,使CRISPR技术在家用自测场景具有独特优势。未来,该技术有望实现"抗原检测般的操作便捷性"与"PCR级别的检测准确性"的完美结合,这正是其备受关注的根本原因。
CRISPR诊断技术主要依托两大技术路径:
Cas12路径:识别DNA靶标并切割DNA探针
Cas13路径:识别RNA靶标并切割RNA探针
其中,Cas13的旁路切割活性由张锋团队率先发现,并据此开发了SHERLOCK检测方法。
在Cas12研究方面,本团队与Jennifer Doudna团队各自独立发现了该蛋白的反式切割活性,并在此基础上开发了相应的检测方法。
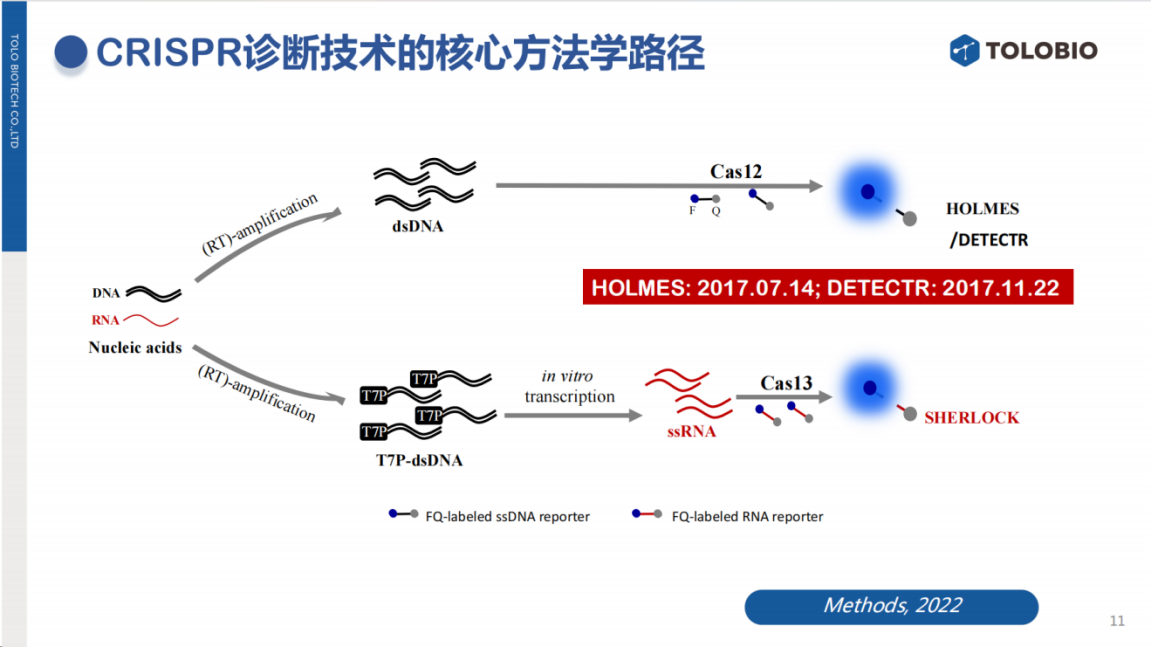
在技术命名方面,各研究团队采用了富有创意的命名策略:
基于Cas13的SHERLOCK(夏洛克)方法与基于Cas12的HOLMES(福尔摩斯)方法共同构成了完整的"分子侦探"系统。
Jennifer Doudna团队则将其方法命名为DETECTR(大侦探)。而在专利布局方面,本团队的专利申请比Jennifer Doudna团队早4个月完成,目前已在包括中国/美国在内的全球主要市场完成专利布局。
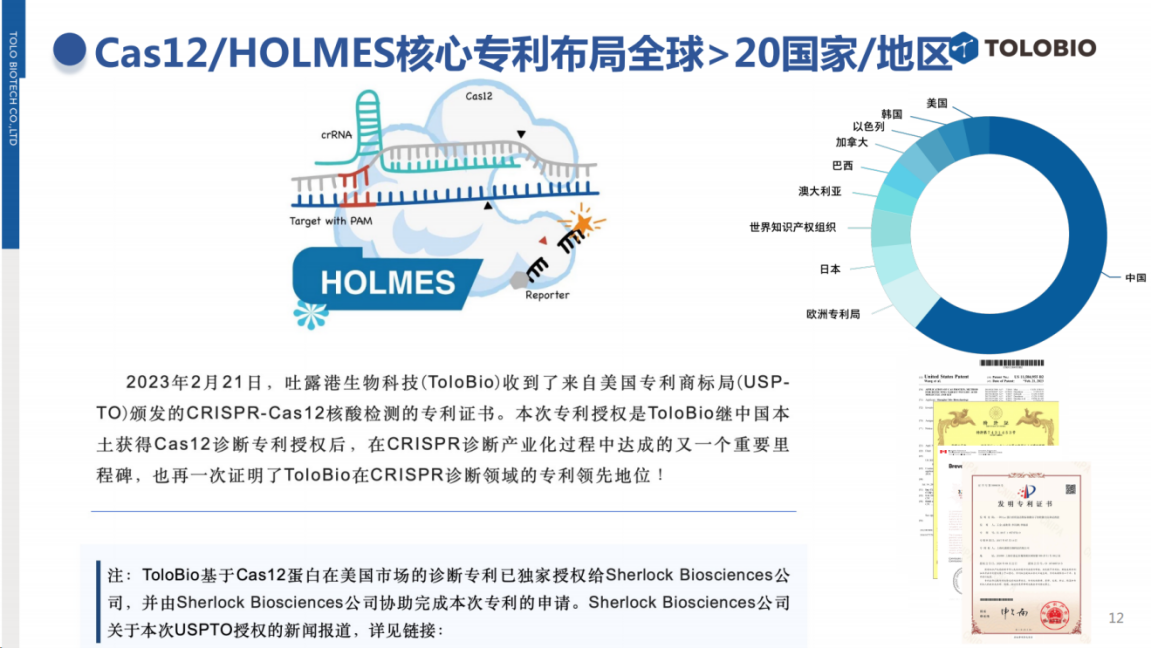
自2019年起,本团队与Sherlock Biosciences公司先后达成战略合作,形成了优势互补的专利共享机制:
大中华区:本团队获得SHERLOCK方法的独家使用权
美国市场:Sherlock Bio获得HOLMES方法的独家使用权
其他地区:双方共享专利使用权
这种合作模式有效解决了潜在的专利壁垒问题,为将来的产品和服务推广扫清了专利障碍。

在CRISPR诊断技术的应用开发方面,本团队最初在研究Cas12切割单链DNA的实验中观察到异常现象:
当靶标核酸标记在一端时,除出现目标条带外,还出现了SMEAR现象;而当标记放在另一端时,则会发生目标条带非预期性缺失的现象。
经过长达一年的深入研究,团队提出了"反式切割"假说,并在随后一个月内完成大部分实验验证,最终证实Cas12蛋白具有反式切割活性。
基于这一发现,团队开发了HOLMES检测系统,该系统在2017年已实现一小时快速检测,而现今检测时间可缩短至十几分钟。
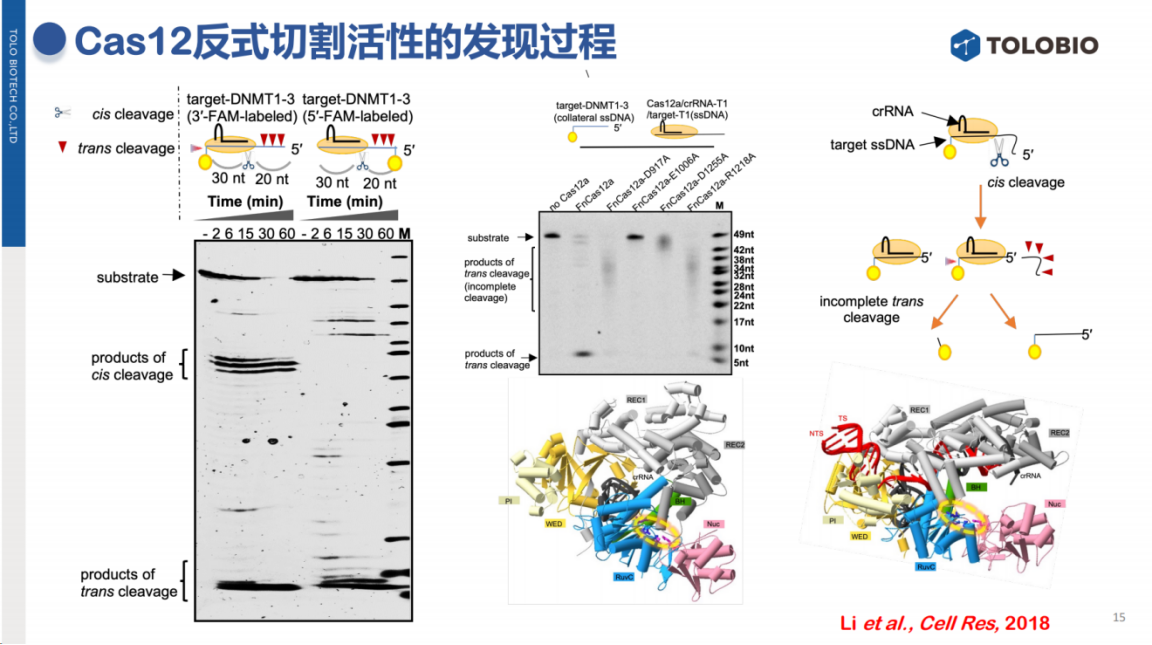
技术原理可简述为:当靶标核酸存在时,Cas蛋白被激活并切割探针释放信号;反之,信号检测可反推靶标核酸的存在。Jennifer Doudna团队开发的DETECTR方法与本团队的HOLMES方法具有相同的技术原理。


SHERLOCK技术的核心原理与前述方法一致:当靶标核酸存在时,Cas13蛋白被激活并切割探针释放检测信号。
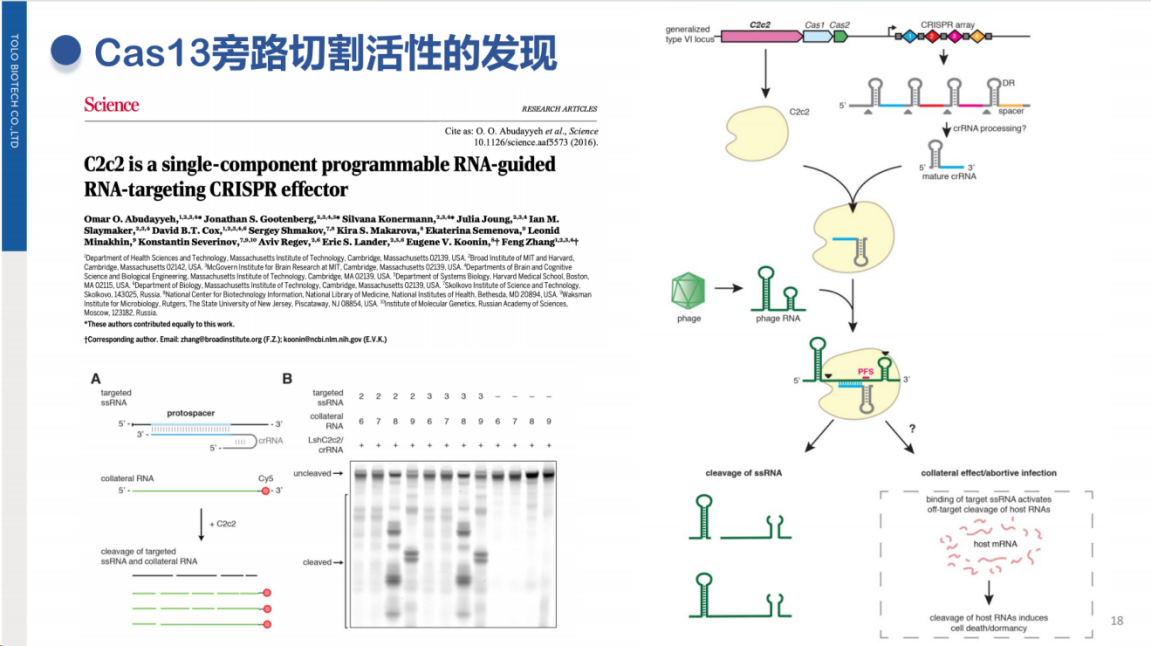
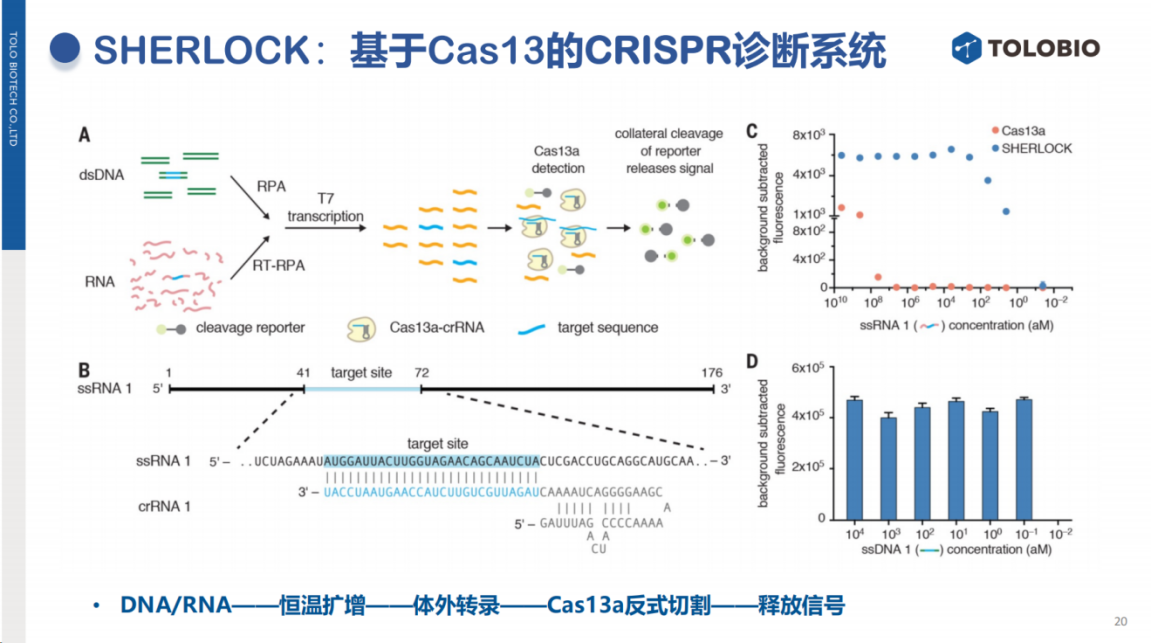
除核酸靶标检测外,CRISPR技术还可拓展至非核酸靶标检测领域。
本团队近期发表的一篇综述文章,系统归纳了CRISPR在非核酸检测中的应用。这些非核酸靶标包括重金属离子、特定抗原及代谢物等,其检测原理在于这些靶标能够激活CRISPR系统的反式切割活性,进而通过探针切割产生可检测信号。
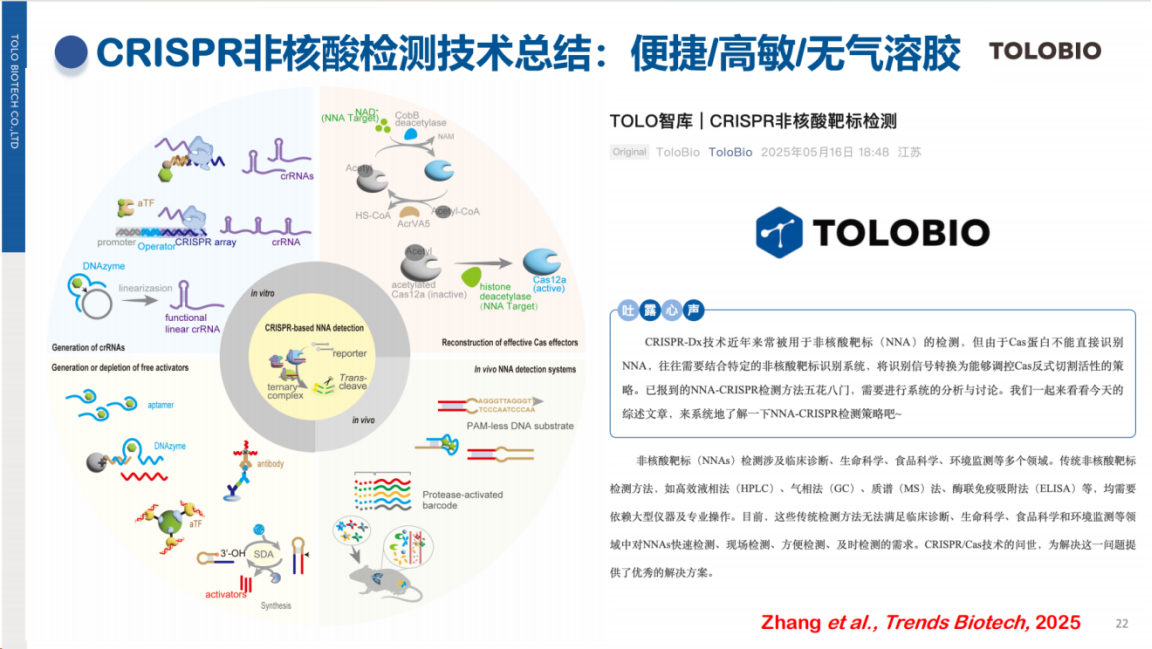
该技术的关键在于利用适配体或抗体等分子识别元件特异性结合非核酸靶标,并将识别信号传导至Cas蛋白,从而激活其反式切割活性。
CRISPR反式切割活性具有高灵敏度和快速响应的特点,且整个检测过程无需复杂设备,仅需恒温条件即可完成。此外,CRISPR技术还可与胶体金等简便检测方法联用,进一步降低设备依赖。
本团队在Cas12蛋白功能调控机制研究中也获得了一些发现:CRISPR系统作为细菌和古菌的天然防御机制,可抵御噬菌体入侵,其作用机制类似于宿主的"杀毒软件"。
然而,噬菌体可通过anti-CRISPR系统对Cas蛋白进行修饰使其失活。有趣的是,宿主细胞可进一步通过修饰重新激活Cas蛋白功能,使得宿主再次获得防御能力,并形成了"宿主-噬菌体"相互博弈的调控模式。
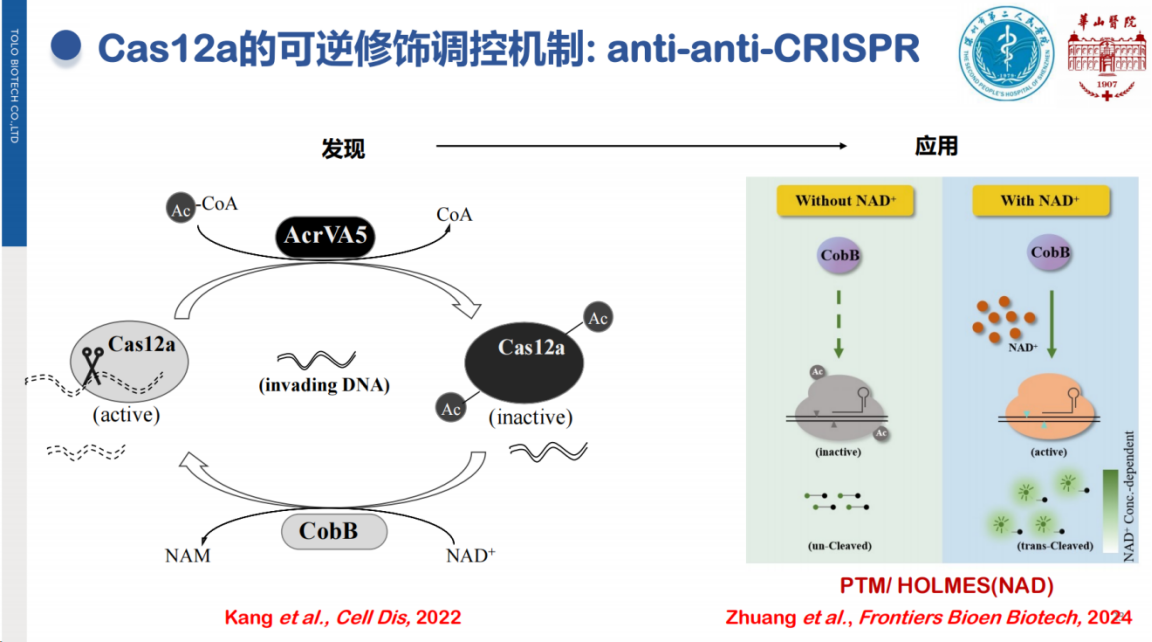
基于这一发现,团队开发了非核酸靶标NAD+检测的方法。NAD+作为重要代谢物与多种疾病密切相关。
本检测方法的核心原理是利用NAD+靶标分子触发去乙酰化反应,进而激活Cas蛋白切割探针产生信号。
所有CRISPR检测的核心逻辑均遵循"靶标存在与否导致信号变化"的基本原则,检测结果表现为信号增强、产生或减弱等模式。
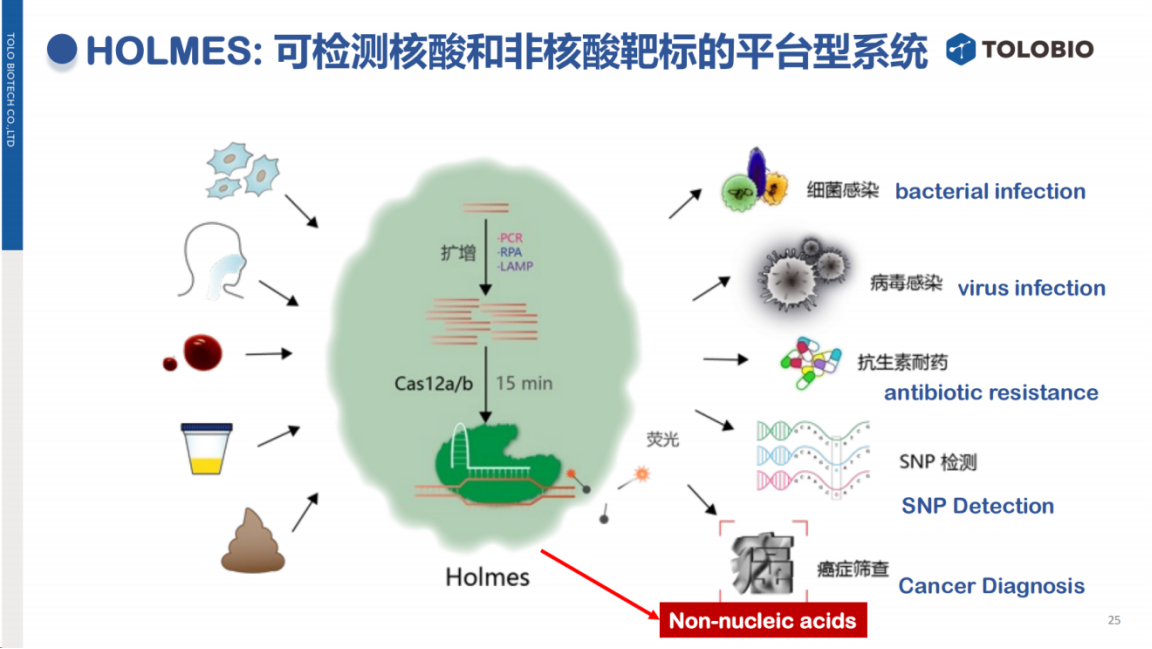
综上所述,CRISPR技术是一个兼具核酸与非核酸检测能力的通用平台,可适应多种样本类型和检测需求。
回顾CRISPR技术被公认为"下一代诊断技术"的原因,关键在于其解决了行业核心痛点:在众多实验室开发的技术中,只有真正满足实际需求、解决行业痛点的技术才能最终被广泛应用。
从分子诊断技术的发展历程来看,PCR技术的诞生显著提升了检测的灵敏度和特异性,开创了分子诊断时代。
然而,PCR技术在某些实际应用场景中也会面临着通量受限的问题。当检测靶标数量从数个增加到数千个,或样本量大幅增加时,传统PCR技术难以满足高通量需求。
正是在这一背景下,NGS(下一代测序)技术应运而生,其核心优势在于能够实现大规模平行检测,在提高通量的同时,显著降低单个靶标的检测成本。
而CRISPR技术面临的挑战则是能否凭借其高灵敏度、快速检测和设备简化的优势,让检测变得更加简单、快捷。
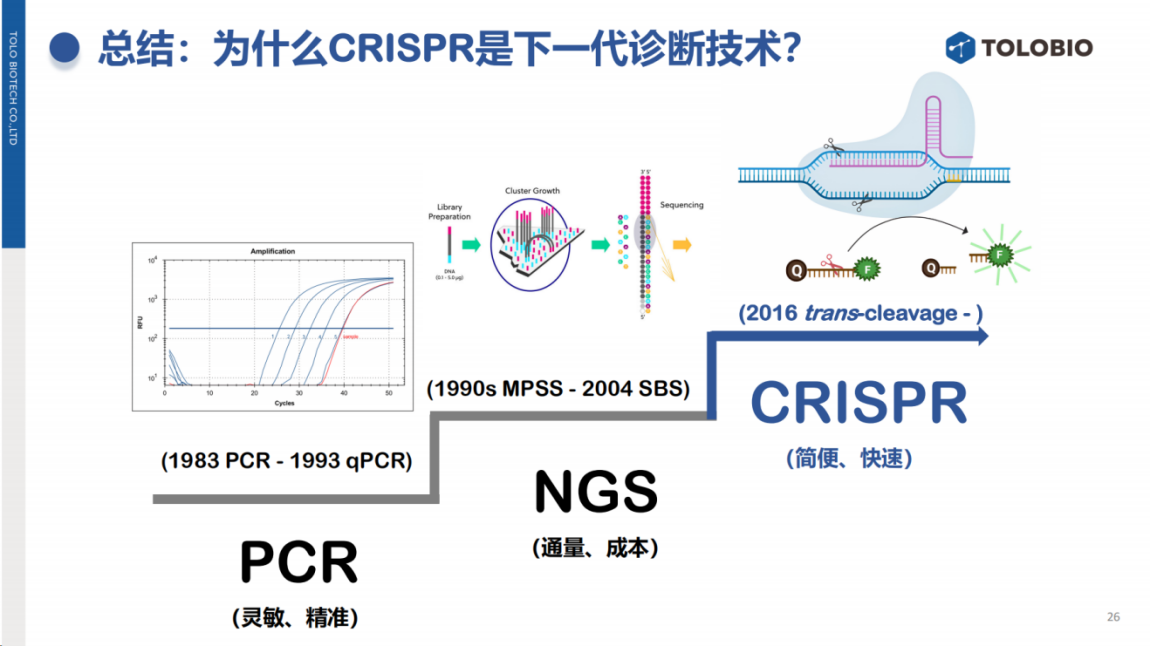
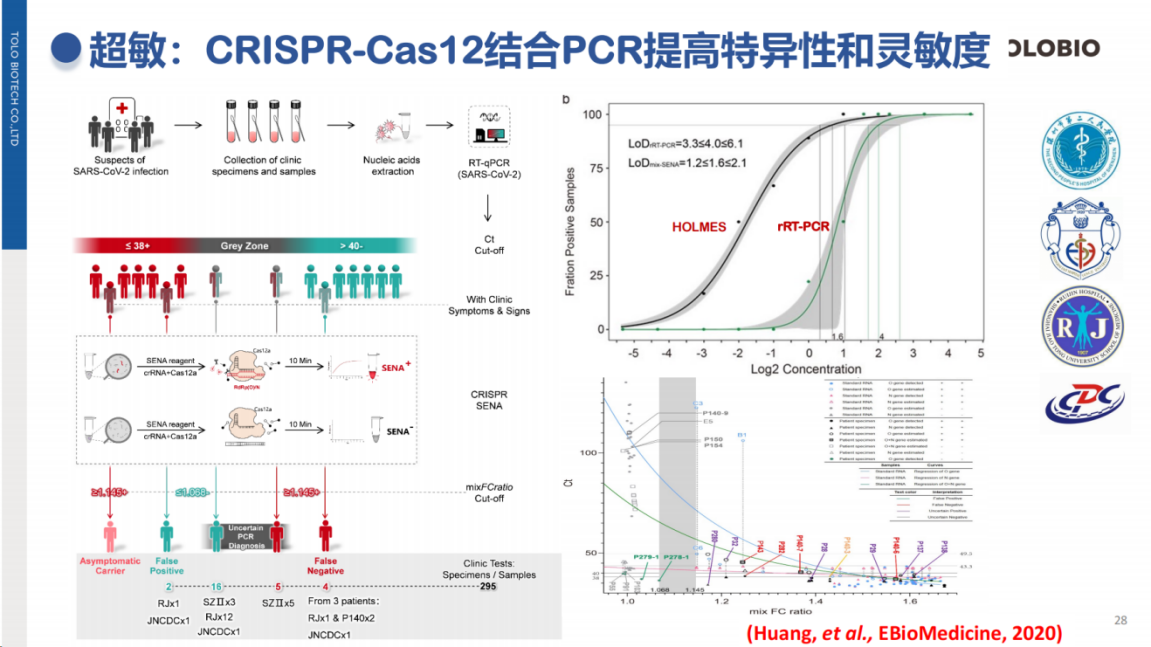
在临床应用方面,CRISPR技术已展现出优势。疫情期间,多机构联合研究首次利用临床样本证实,CRISPR技术的检测限(LoD)优于常规RT-qPCR。
在结核病快速检测中,CRISPR技术对痰涂阴性样本(细菌载量较低)的检出率具有明显优势。杜兰大学团队最新的研究进一步证明,CRISPR技术能够有效检测出血液中痕量的结核分枝杆菌游离DNA(cfDNA),这一突破不仅为结核检测带来了新的解决方案,也为其他场景,包括血流感染等痕量靶标的检测提供了新的思路。
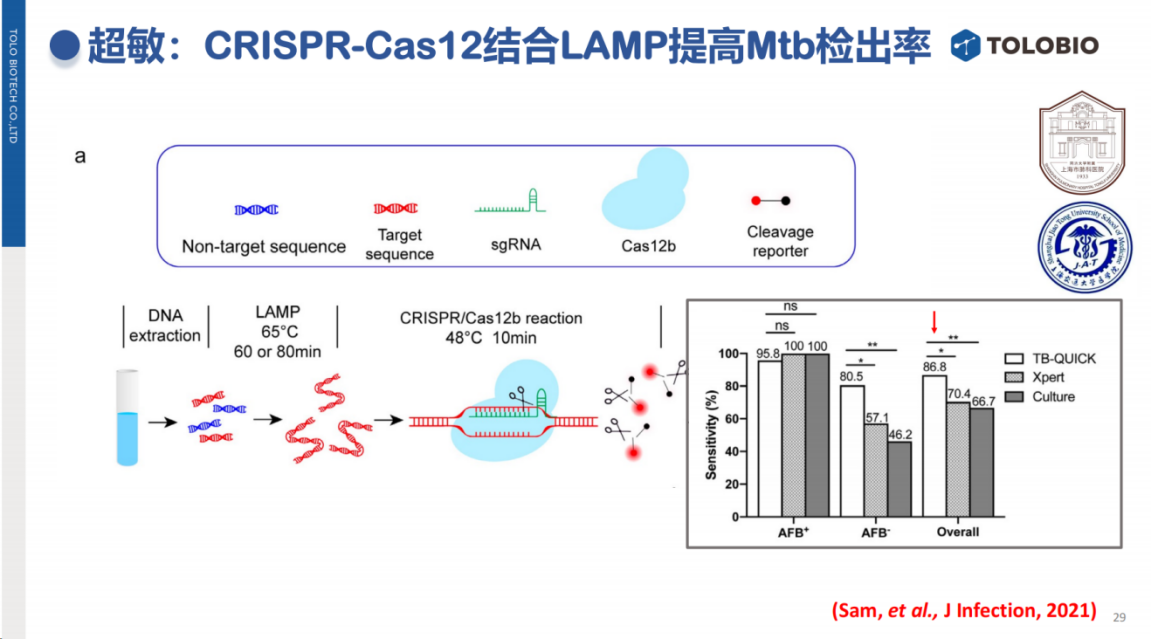
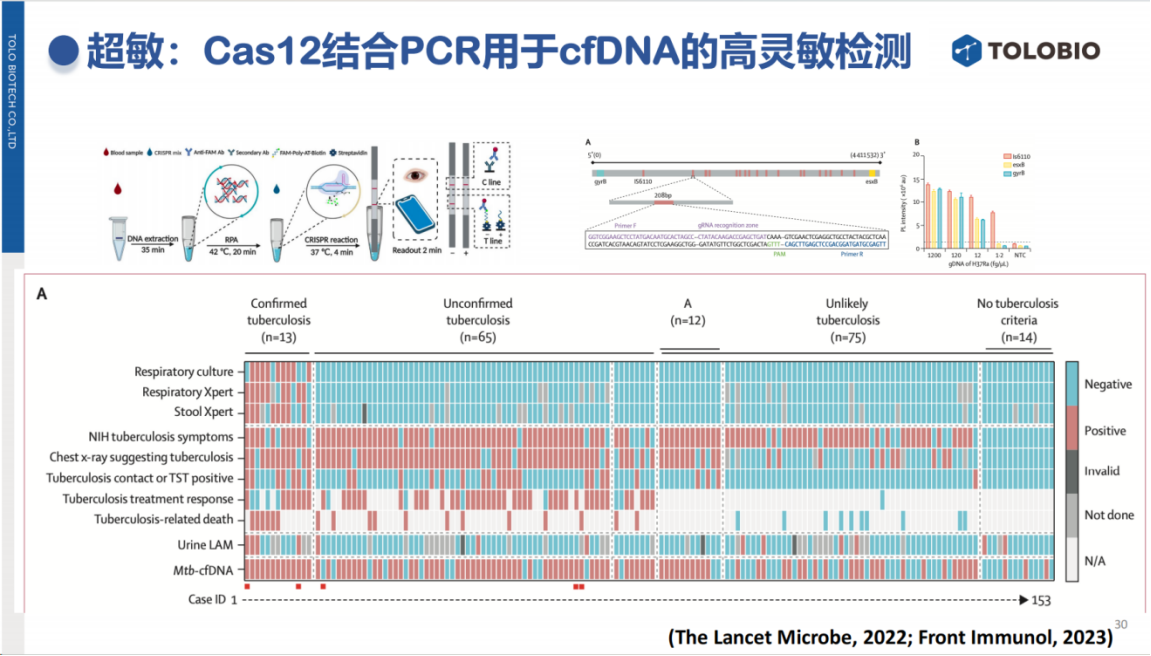
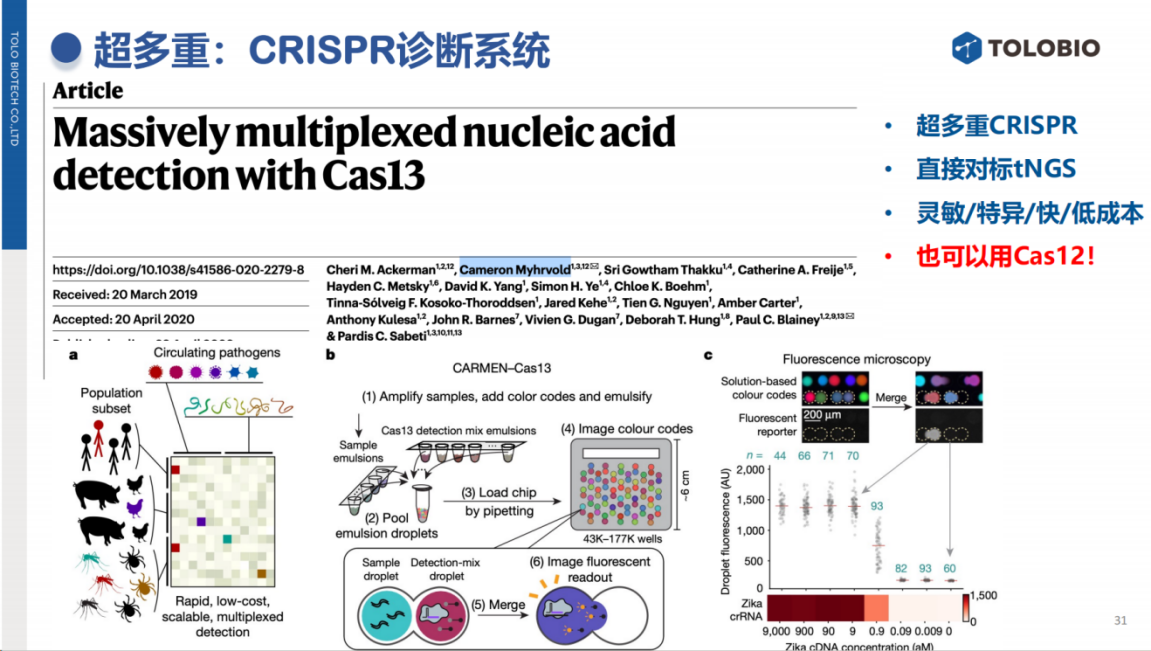
值得关注的是,CRISPR技术在超多重病原检测领域具有重要应用前景。
其技术路径与靶向NGS(tNGS)类似:首先进行超多重PCR扩增富集,随后以CRISPR技术替代测序步骤,在10分钟内完成信号输出和检测。这一方法避免了传统测序所需的高成本精密设备、长时间的检测流程和专业的数据分析等,为病原体筛查提供了更高效、更低成本的替代方案。
此外,CRISPR技术可与试纸条检测相结合,进一步降低设备依赖。吐露港公司开发的"小精灵GeneLinker"小型设备,充分体现了CRISPR技术"低设备依赖、高检测性能"的核心优势。
综合来看,CRISPR技术不仅能够满足核酸自测的需求,在临床检测、超多重筛查等领域同样展现出广阔的应用前景,也代表了分子诊断技术发展的新方向。
家庭自测领域具有重要发展前景,值得持续关注。
除临床研究外,CRISPR诊断技术的产品化进程已取得显著进展。
国际上,Sherlock Biosciences获得了全球首张CRISPR诊断产品证(FDA EUA),Mammoth Biosciences的新冠检测产品获得美国EUA紧急使用授权。在国内,上海伯杰医疗和杭州众测生物等企业积极推进产业化进程。


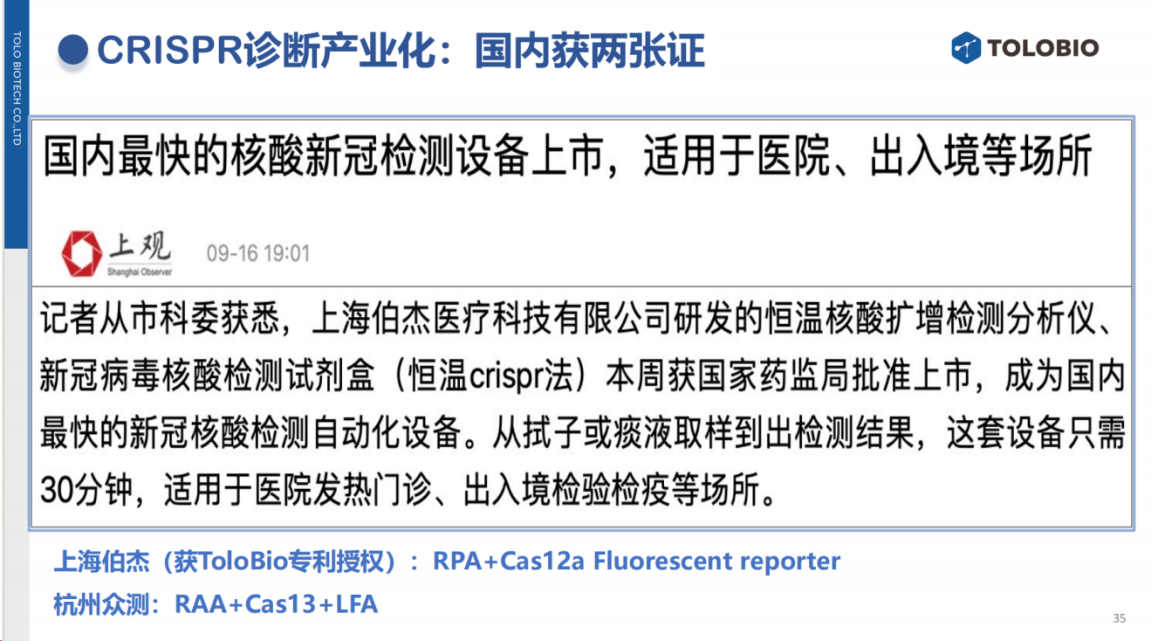
ToloBio的合作伙伴IntelliGenome公司在基于血液cfDNA的结核检测领域也取得了突破性进展,其产品于年初获得FDA突破性医疗器械认定。
目前,越来越多的企业正致力于推动CRISPR诊断技术的产业化进程。自2016-2017年发现CRISPR可用于诊断至今已近十年,经过持续探索,该技术不仅获得科研界关注,更吸引了产业界的广泛参与。

在此简要介绍吐露港生物的发展情况。
公司以"基于CRISPR创新科技解决全球健康威胁"为使命,致力于推动检测技术向更简便的方向发展。ToloBio拥有CRISPR诊断领域的底层专利和方法学专利,并积极构建CRISPR诊断产业生态。作为开放型创新平台,公司秉持合作共赢理念,为行业伙伴提供核心原料和整体解决方案。


公司在上海设有运营中心,在无锡建有GMP生产车间和研发中心,并持续获得投资方支持。
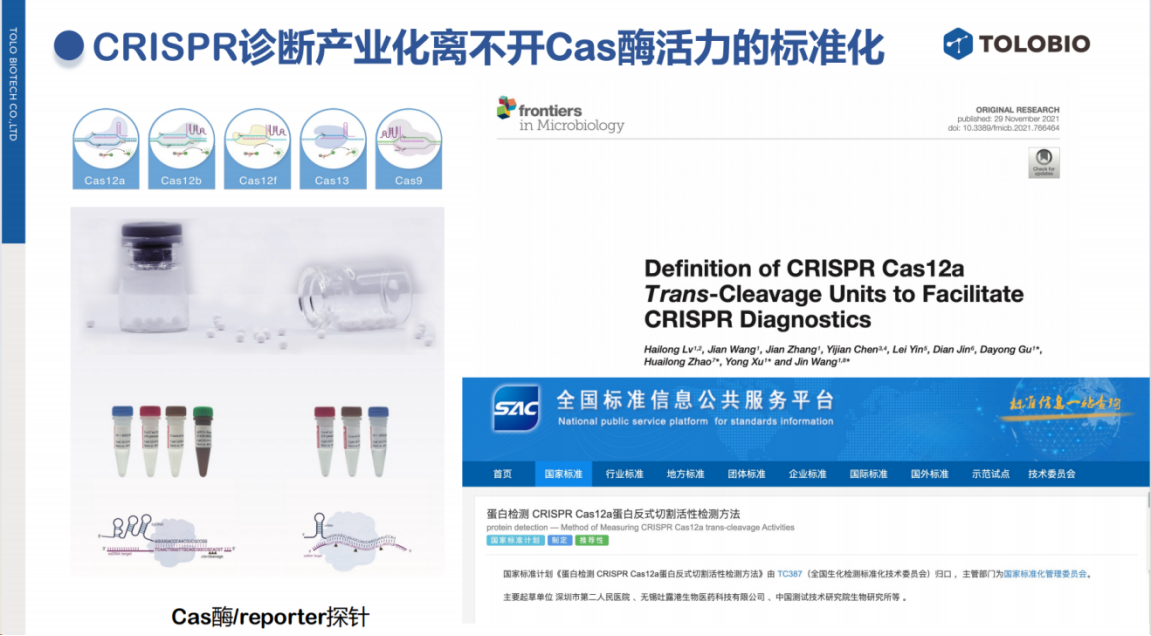
ToloBio期待与各方开展从专利授权、产品开发到临床应用的全方位合作。同时,公司高度重视CRISPR诊断技术的标准化建设,去年联合多家单位共同推进Cas12蛋白反式切割活性的标准化工作,率先开展CRISPR酶标准化研究。

目前,ToloBio提供最全面的Cas蛋白产品线,并持续优化实验流程。例如,传统克隆实验需要2-3小时的前期准备,而ToloBio开发的创新方法仅需5分钟即可完成,显著提升了实验效率。欢迎关注公司公众号获取最新研究进展。






发表评论 取消回复