复旦大学王瑞副研究员报告:《CRISPR分子诊断方法开发与应用》


2025年6月7日,由中国医药生物技术协会生物诊断技术分会主办,首期“生物诊断前沿技术专题会”在北京亦庄生物医药园召开。专题会聚焦《CRISPR诊断技术的创新与转化》。
生物诊断公众号将对各专家汇报内容进行汇编整理,供关注CRISPR诊断技术的业内同仁学习参考。
本期分享复旦大学王瑞副研究员报告:《CRISPR分子诊断方法开发与应用》。


在临床样本检测实践中,我们发现传统方法在灵敏度、特异性、检测周期和成本等方面均存在明显不足。
针对这些问题,我们致力于开发新型CRISPR检测方法,旨在显著提升检测性能,同时简化操作流程。此外,我们还开发了配套的微流控设备,将方法与装备有机结合,推动POCT分子诊断的实际应用。
本团队的研究特色在于:紧密追踪技术前沿,立足实际需求,通过持续的技术创新,实现从定性到定量、从实验室研究到POCT应用的完整技术转化。
正如王金老师所述,CRISPR技术正在引领下一代分子诊断的发展。
众多顶尖学者,包括张锋教授等,已发表大量CRISPR相关研究成果,这些新兴的CRISPR工具被誉为下一代分子诊断技术的代表。

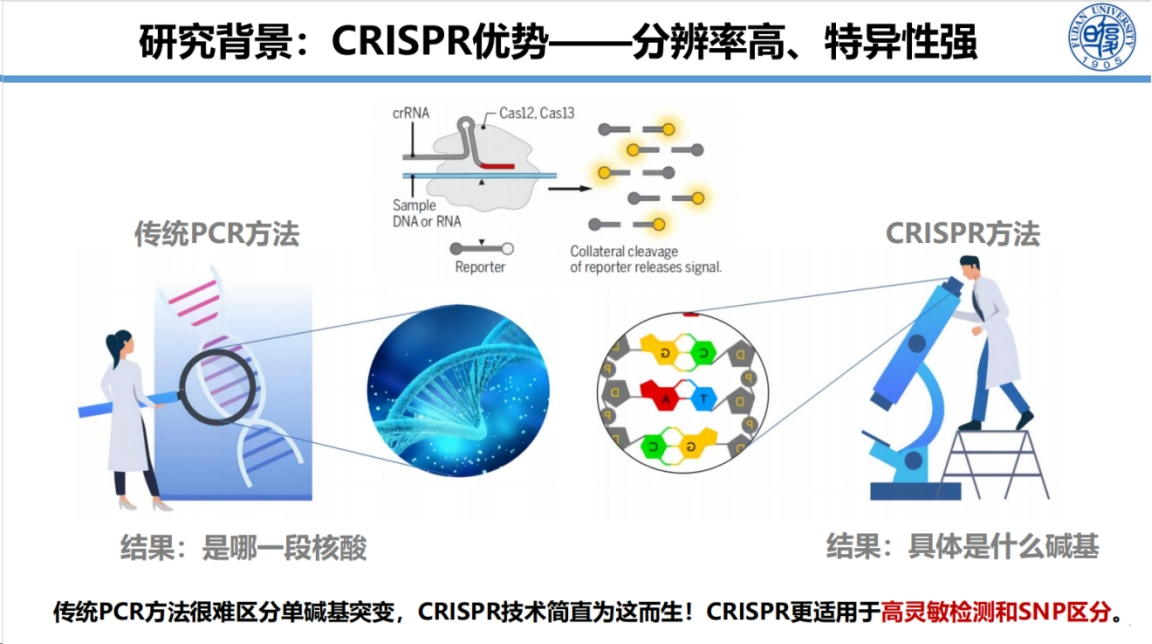
CRISPR技术具有无可比拟的优势:其最突出的特点是极高的分辨率和特异性。与PCR技术相比,传统PCR在检测单碱基突变时存在明显局限,而CRISPR系统能够精准识别单个碱基的差异。
形象地说,若将PCR比作放大镜,CRISPR则相当于显微镜,特别适用于SNP位点的高特异性检测。
在产业化方面,国际国内均已取得显著进展。张锋教授等已创立相关企业,我国王金老师创立的吐露港生物也表现突出。
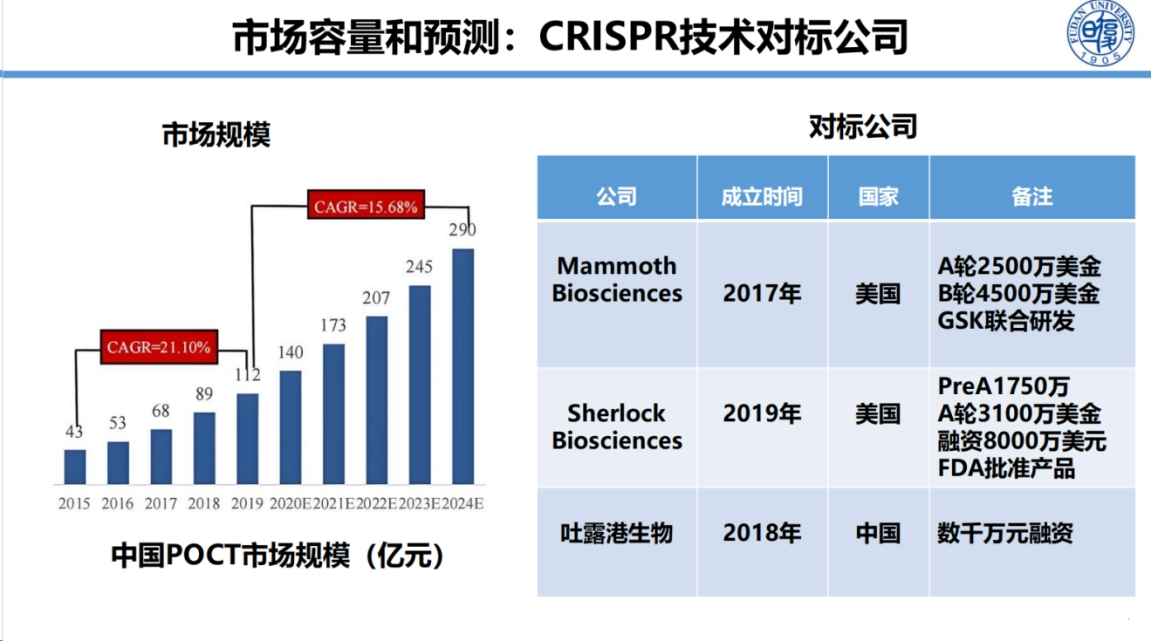
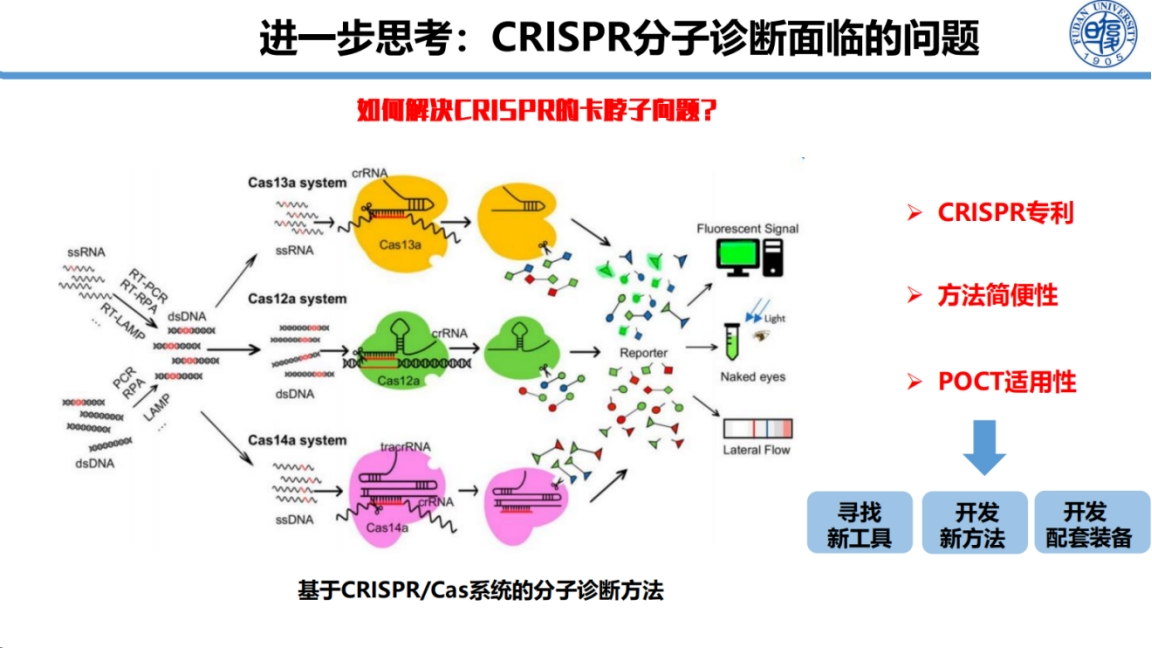
面对广阔的市场前景,我们需要深入思考CRISPR技术从科研到产业化过程中面临的关键挑战。
主要包括三个方面:
首先是CRISPR-Cas系统的专利布局问题,需要开发更多新型Cas酶以构建自主专利池;
其次是现有检测方法的便捷性优化,确保非专业人员能够轻松操作;
最后是配套设备的开发,解决技术应用的"最后一公里"问题。
针对这些挑战,我们的研究重点明确:
一是开发新型CRISPR-Cas工具;
二是构建更简便的检测方法;
三是研制配套设备,推动家用和基层检测应用。
在新型工具开发方面,随着AI技术的发展,Cas酶的改造与优化仍处于快速发展阶段,存在广阔的探索空间。通过开发新型Cas酶,我们将获得独特的技术优势。
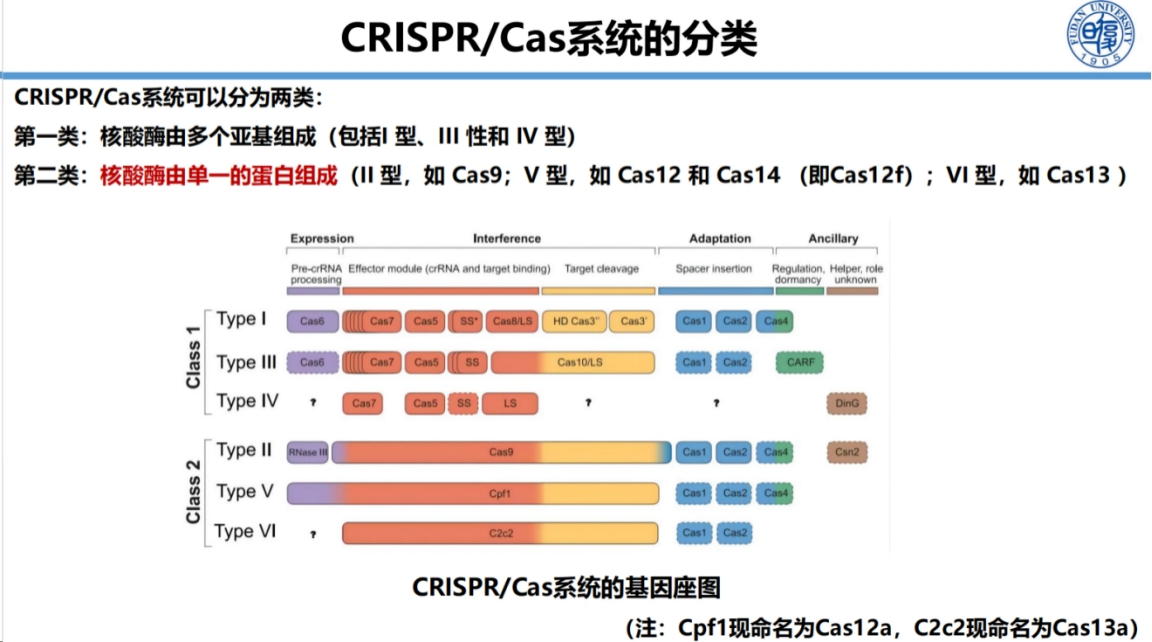
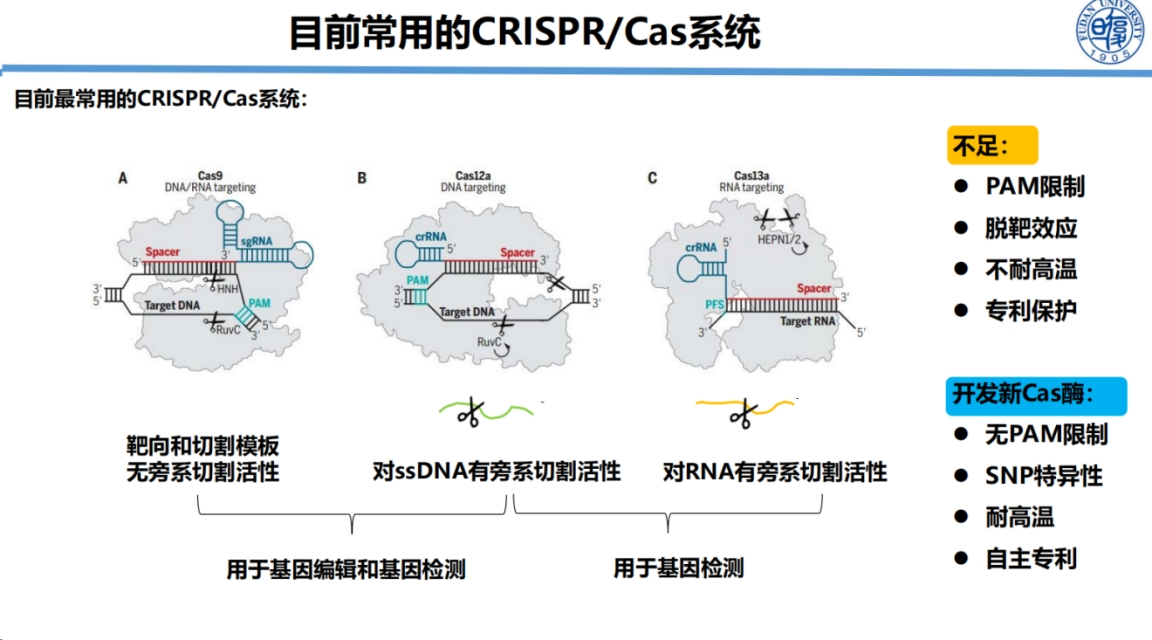
CRISPR系统可分为多亚基和单亚基两类。
考虑到工具的易用性,我们优先选择开发单亚基系统,如Cas9、Cas12和Cas13系列,致力于将其转化为高效实用的分子诊断工具。
开发新型Cas酶的主要动因在于现有系统存在若干关键性局限。
首先,PAM序列限制显著制约了CRISPR技术的应用范围。
Cas9依赖NGG PAM序列,Cas12系列需要TTTN等PAM序列,而Cas13虽然无需PAM序列但仅适用于RNA检测。
我们致力于开发不受PAM序列限制的新型酶,以实现任意核酸序列和SNP位点的自由检测,从而大幅拓展CRISPR技术的应用场景。
其次,现有Cas酶与扩增技术的兼容性不足。
当前检测流程需要先进行扩增再转入CRISPR检测体系,这种分离操作不利于开发简便的检测方法。
我们计划开发具有良好温度耐受性和强兼容性的新型Cas酶,实现扩增与检测的一体化操作。
第三,专利壁垒问题亟待解决。
为突破国外技术封锁,我们亟需自主开发和改造Cas酶,构建自主知识产权体系,为后续产品开发奠定基础。
Cas酶系统的工作原理本质上需要三个核心元件:具有切割活性的Cas酶、定位作用的PAM序列以及连接靶标与Cas酶的向导RNA。
开发新型Cas酶的关键在于识别这三个元件的优化组合。
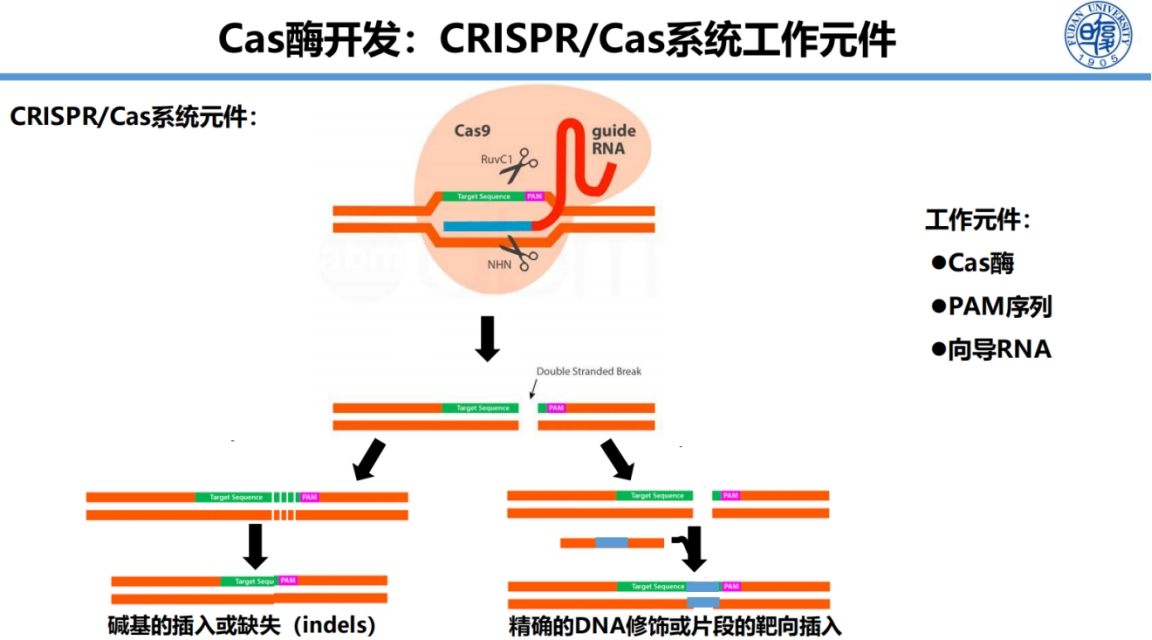
在开发策略上,团队从DNA修复机制中获得重要启示。细胞在DNA双链断裂后主要通过快速拼接方式进行修复,这一过程中常伴随碱基的增加或缺失。
基于此原理,团队设计了新型Cas酶开发方案。
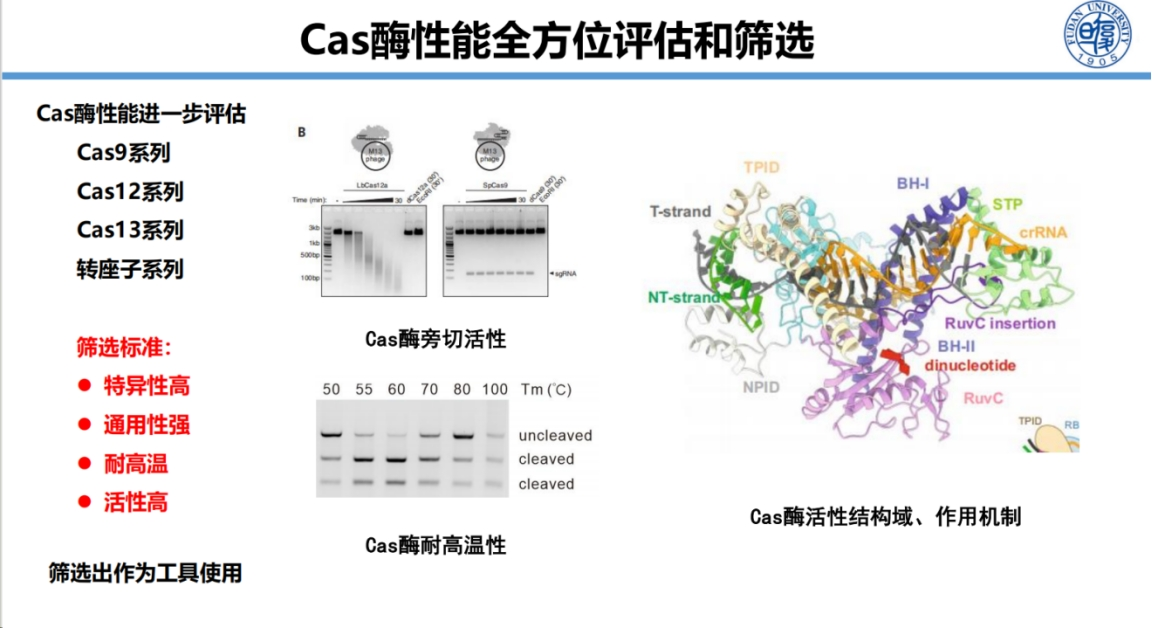
在Cas酶改造方面,团队开发了Cas蛋白定向进化系统和Cas酶定点改造方法。
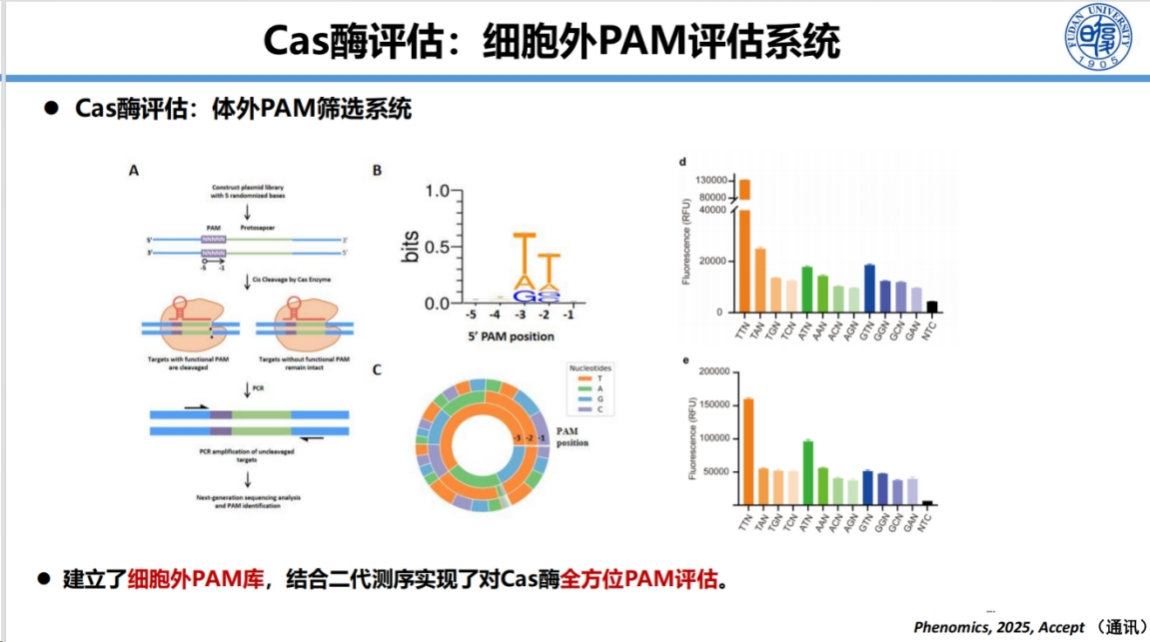
此外,为拓展PAM序列的应用范围,团队建立了体外PAM序列全方位评估系统。
以上方法为团队自主开发和改造Cas酶,拓展Cas酶的靶向和检测范围奠定了基础,极大提升了CRISPR系统的检测效率。
在CRISPR检测方法开发方面,我们以"更快、更高、更强"的奥林匹克精神为指导持续创新。
"更快"体现在检测速度的突破,目标实现10分钟内完成检测;
"更高"追求检测性能的提升,包括灵敏度和特异性的优化;
"更强"则致力于方法的简便性和普及性,使其适用于基层和家庭场景。
自2017年张锋和Doudna首次报道CRISPR体外诊断方法以来,我们持续进行技术迭代。
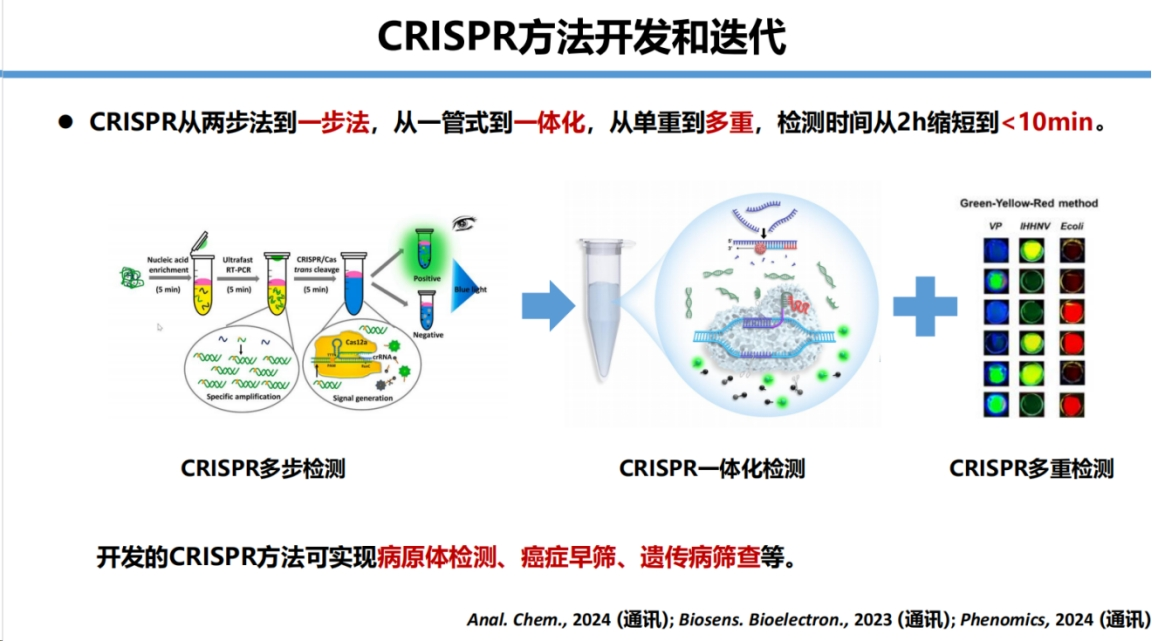
从最初的两步法发展到一步法,从多管操作优化为一管化反应,从单重检测扩展到多重检测,将检测时间从2小时缩短至10分钟。
这些方法已成功应用于病原体感染检测、耐药性分析、癌症热点突变筛查、伴随诊断和遗传病筛查等多个领域。
1、让检测速度“更快”
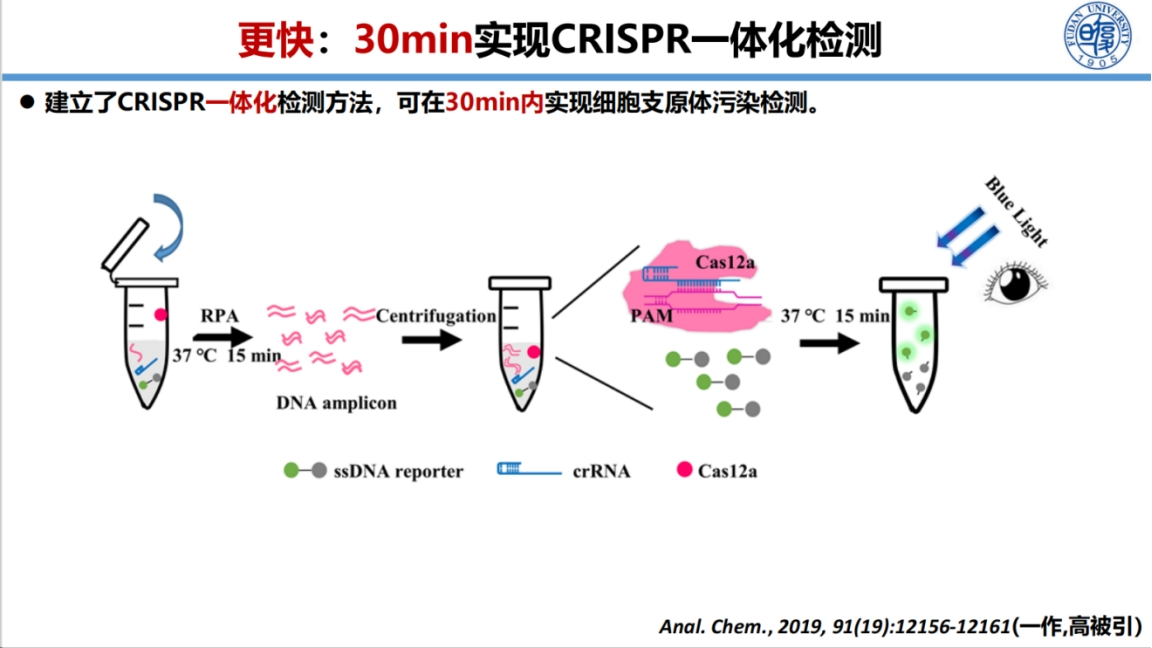
我们早期开发的30分钟一体化检测方法已较为成熟,通过将RPA扩增与CRISPR检测整合在一管中,肉眼即可判读结果,该成果已成为高被引论文。
在此基础上,我们进一步开发了10分钟快速检测方法,持续推动CRISPR诊断技术的创新发展。
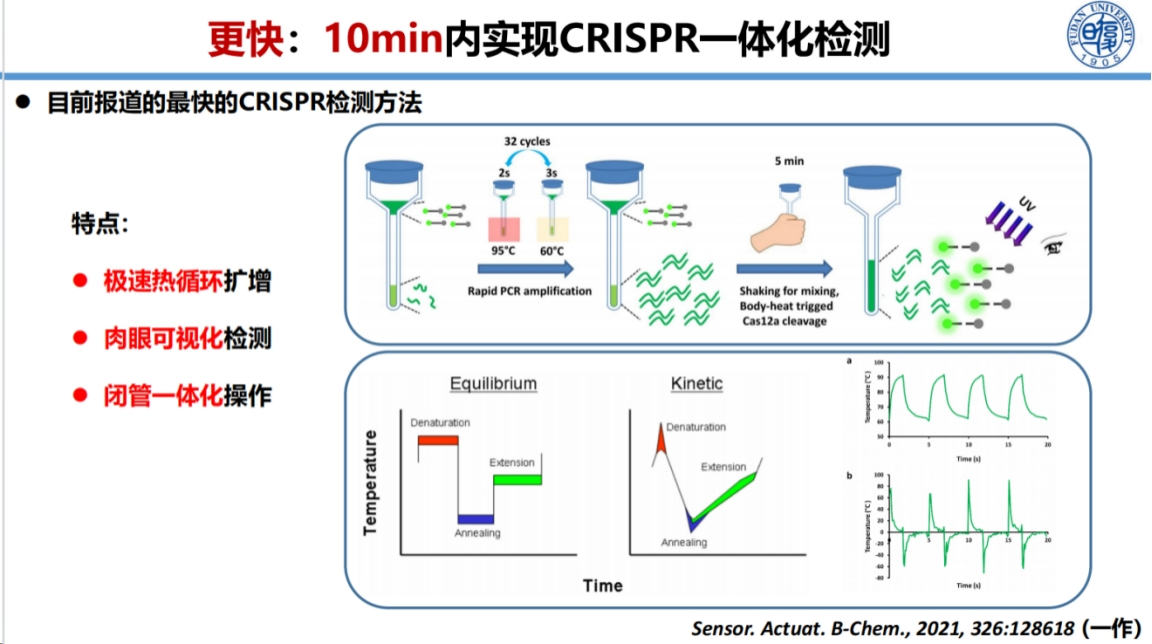
在快速PCR技术开发方面,我们实现了3min内完成扩增反应的技术突破。
这一突破主要依赖于优化的热传导系统,能够快速实现95℃的变性和60℃的退火延伸过程。扩增产物随后与CRISPR系统结合,通过切割反应实现可视化检测。
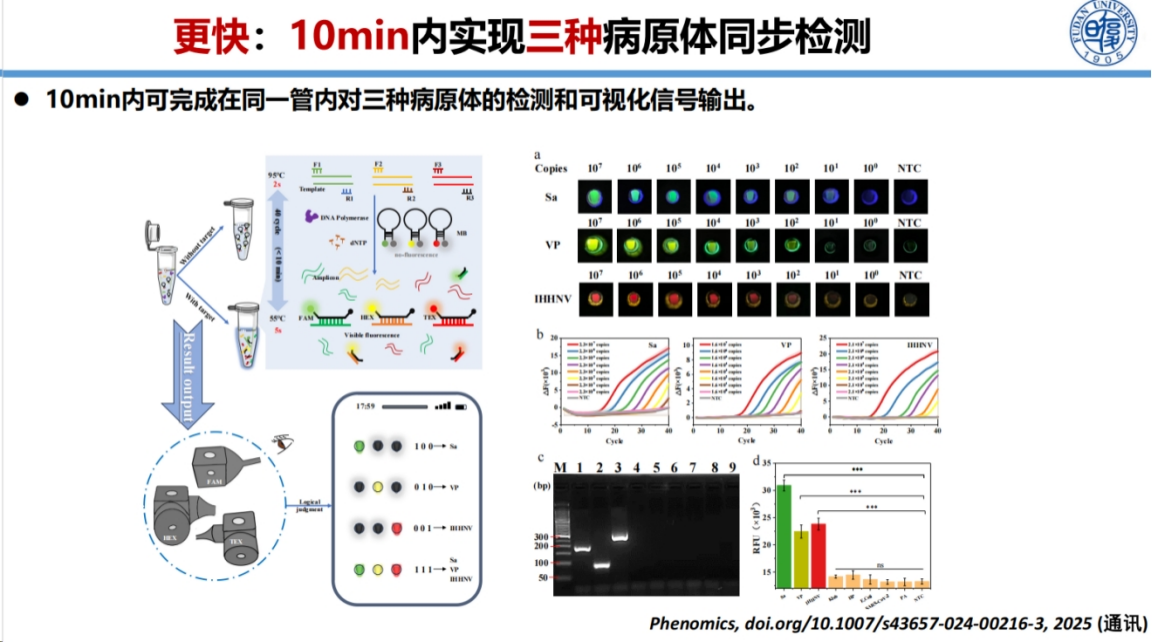
为进一步提升检测能力,我们开发了多重病原体同步检测技术。
该技术采用分子信标方法结合快速PCR扩增,通过设计三种不同标记的分子信标分别识别三种靶标分子。分子信标本身为茎环结构,荧光基团与淬灭基团相邻时荧光被淬灭。当与靶标结合后,茎环结构打开,荧光信号释放。
这种方法实现了三种病原体的同步检测和肉眼区分。
2、让检测性能“更高”
在检测灵敏度提升方面,我们开发了基于LAMP扩增与CRISPR结合的高灵敏度检测方法。
该方法通过两重信号放大机制实现单分子水平的检测:第一重放大来自LAMP扩增,第二重放大来自CRISPR系统的报告分子切割。这种双重放大机制显著提高了检测灵敏度,相关成果已成为高被引论文。
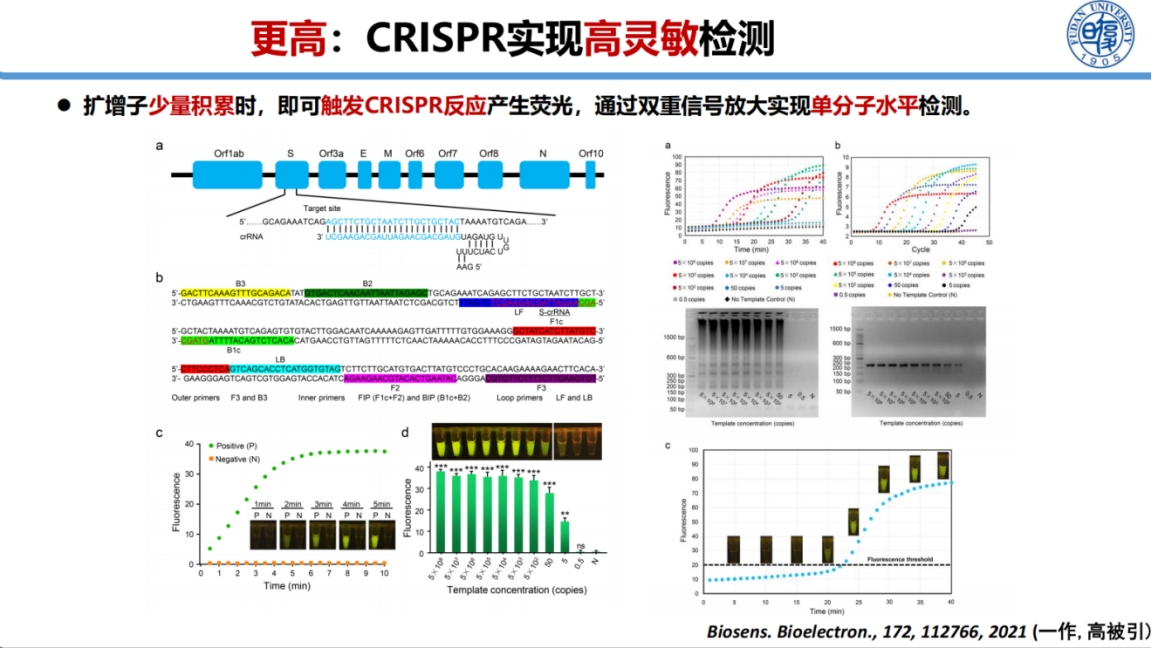
一体化检测方法的开发是另一重要突破。
我们将恒温扩增与CRISPR检测整合在单一反应体系中,操作简便,仅需加入样本后等待10-30min即可肉眼判读结果。这种方法不仅简化了操作流程,还实现了定量检测能力,解决了CRISPR医学应用中的关键痛点。
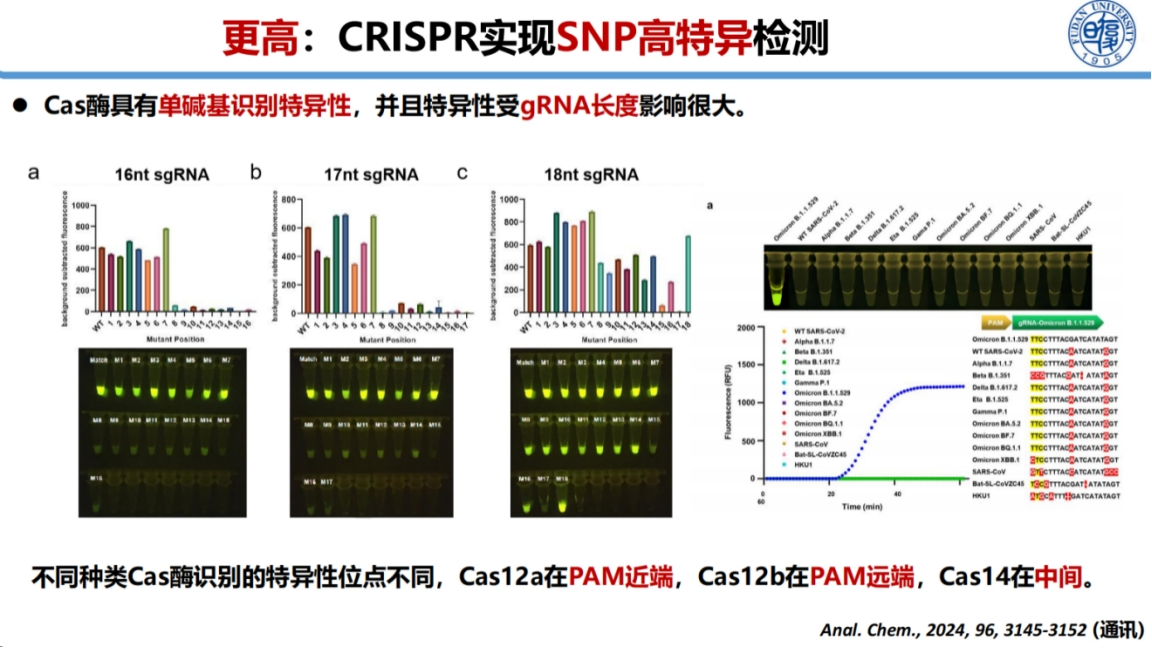
在检测特异性研究方面,我们系统探究了Cas酶和gRNA的特性。
研究发现不同Cas酶的特异性区域存在差异:Cas12a在PAM近端有特异性,Cas12b在PAM远端有特异性,而Cas14则在中间区域表现出特异性。同时发现gRNA长度对特异性有重要影响,较短的gRNA可提高特异性,但过短会影响活性。
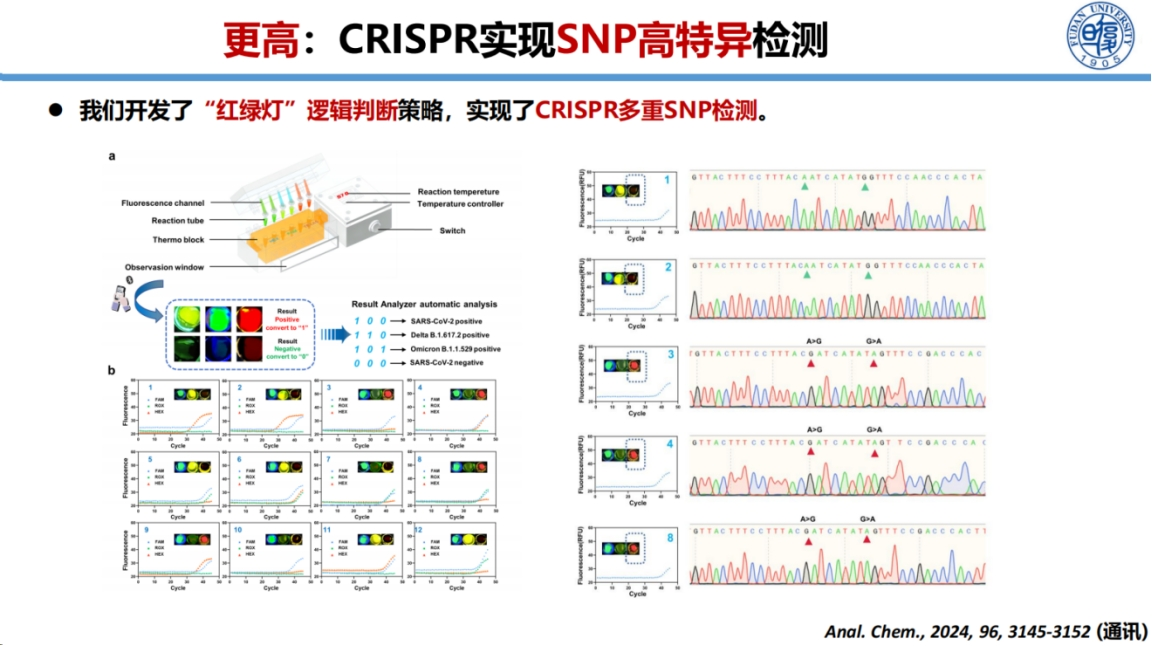
基于这些发现,我们开发了CRISPR多重SNP检测系统。
该系统采用逻辑判断方式,通过三管反应同时检测三种突变(如Omicron和Delta变异株),结合感染状态判断,实现了新冠病毒变异株的精准分型。这一技术为疫情防控提供了重要的检测工具。
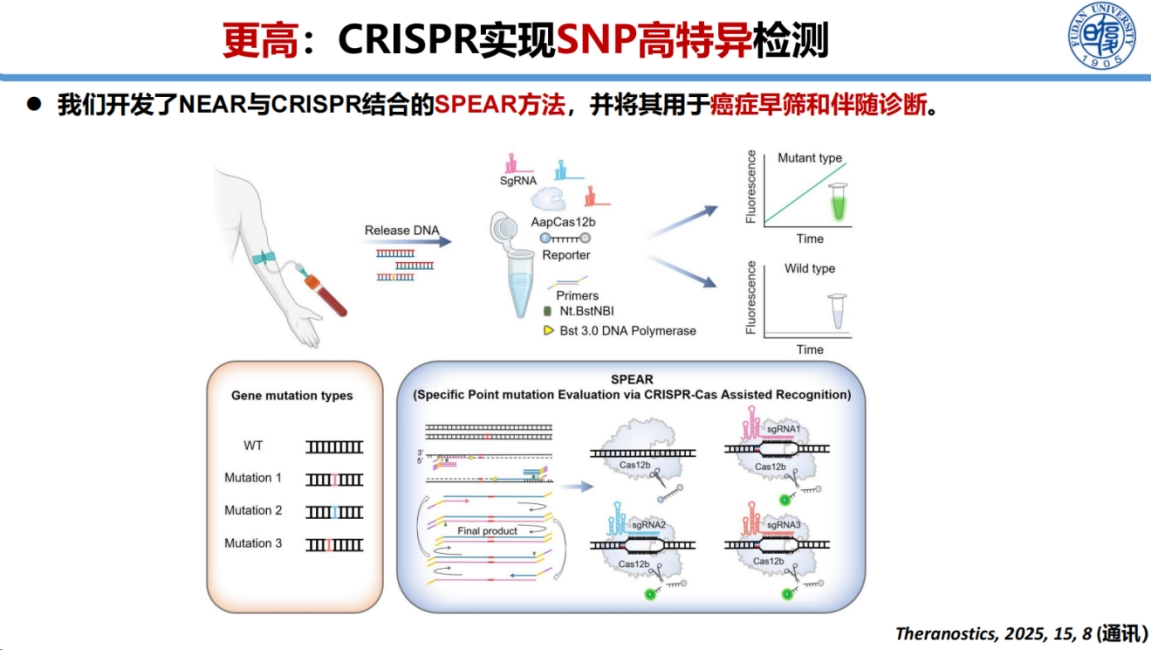
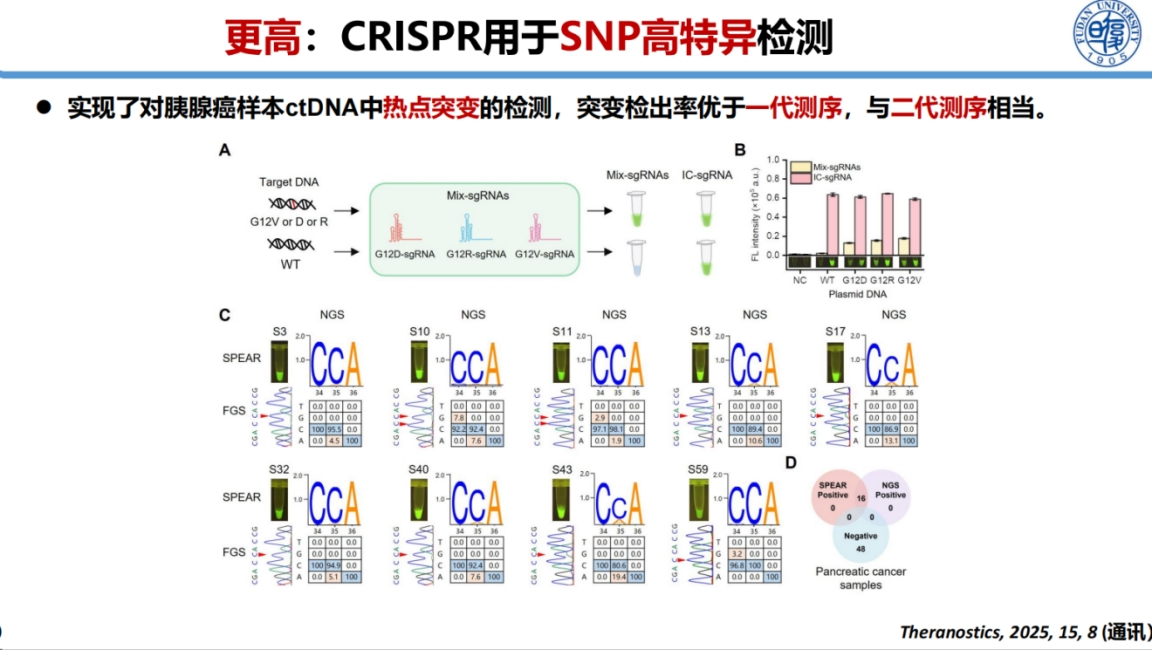
在癌症热点突变检测方面,我们开发了一种名为SPEAR的方法。
该方法将NEAR扩增技术与Cas12b系统相结合,成功应用于白血病和胰腺癌的早期筛查。该方法展现出卓越的检测灵敏度,能够检出0.1%的低频突变。这种高灵敏度检测能力为癌症早期诊断提供了重要技术支持。
与常规测序技术相比,该方法性能显著优于一代测序(仅能检测5-10%以上的突变),与二代测序的检测灵敏度相当,展现出良好的临床应用价值。
该方法还可以识别耐药突变的发生,为临床用药调整提供依据。因此所开发的SPEAR方法在癌症早筛和伴随诊断中展现出巨大应用前景。
3、让检测便捷性“更强”
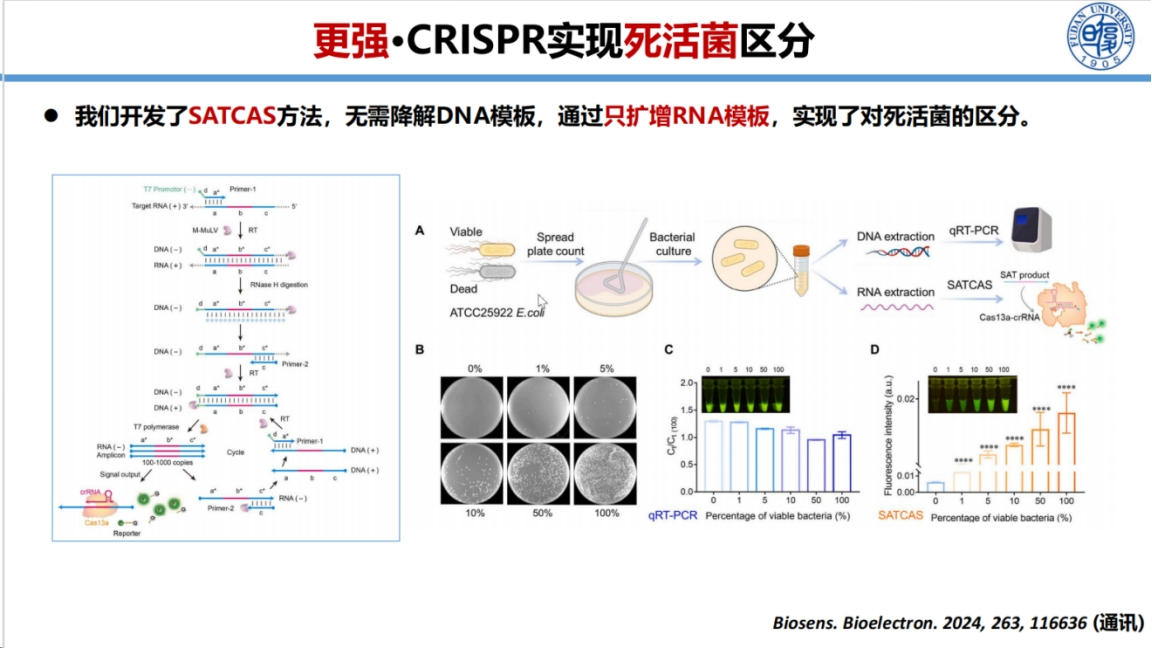
在病原体检测方面,我们开发了名为SATCAS的创新方法。
该方法特异性扩增RNA而不扩增DNA,无需预先降解DNA,可直接用于样本检测。这一特性使其能够有效区分死活菌,并评估病原体在宿主体内的活跃程度,为临床干预提供参考。
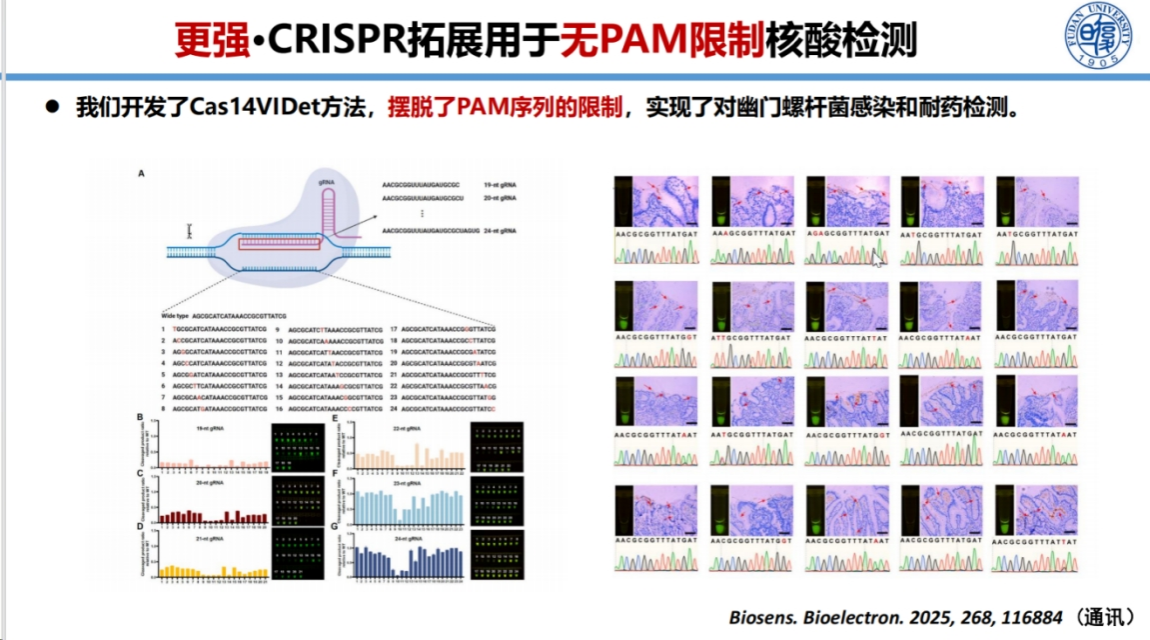
针对PAM序列限制问题,我们采用Cas14系统结合快速扩增技术,开发了无需PAM序列的检测方法。
该方法可在10分钟内完成检测,成功应用于幽门螺杆菌的耐药突变检测。幽门螺杆菌作为I类致癌物,其根除治疗面临挑战。该方法不仅能检测感染状态,还能识别耐药突变,为个体化治疗方案制定提供依据。
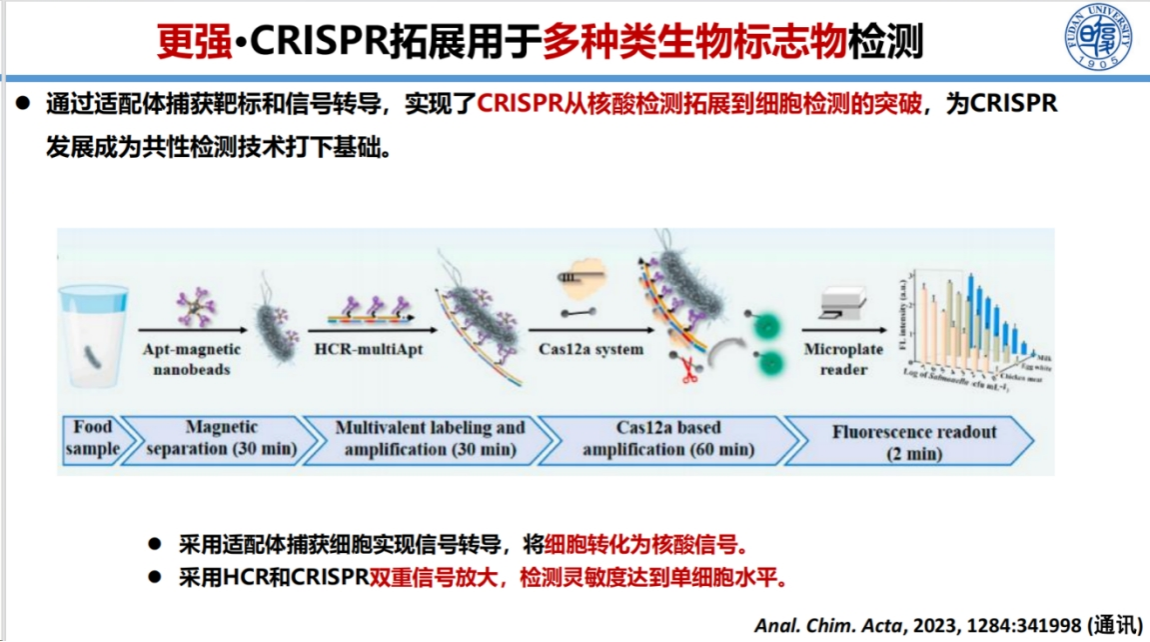
我们进一步拓展了CRISPR技术的应用范围,实现了非核酸靶标高灵敏检测。
通过适配体将非核酸靶标信号转化为核酸信号,再进行扩增和CRISPR检测,可极大提高灵敏度。
此外,采用单抗或适配体直接捕获细菌的策略,无需裂解提取核酸即可实现单个细菌的检测,极大简化了检测流程。
这些技术创新为CRISPR技术在非核酸检测领域的应用开辟了新途径。
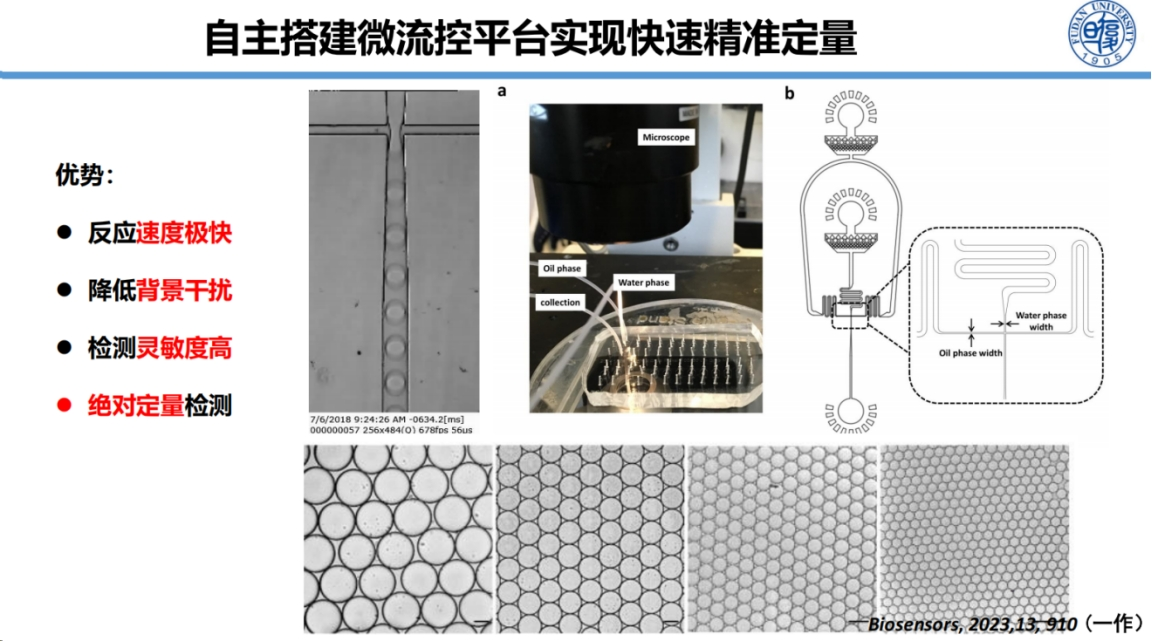
为实现CRISPR技术的临床应用转化,我们开发了液滴数字CRISPR检测方法及配套微流控平台。
该平台能够制备单分散液滴,并实现液滴的精确融合操作。这一技术突破为CRISPR检测的定量化应用提供了关键支持。
我们的方法能够在10分钟内完成检测,并实现每毫升血液中10个CFU的检测灵敏度,充分满足临床手术导航等实时检测需求。
在设备开发方面,我们致力于打造"样本进-结果出"的自动化检测系统。
该系统采用类似洗衣机的操作模式,用户只需将样本放入设备,后续的扩增和检测过程完全自动化,最终通过试纸条直观显示检测结果。
这种设计极大简化了操作流程,特别适合资源有限地区的应用场景。同时,我们开发了配套的在线分析软件,进一步提升用户体验。


总体而言,我们的研究工作涵盖了CRISPR新工具酶开发、检测方法创新和配套设备研制等多个维度。
这些成果已成功应用于人类感染性疾病、基因突变检测以及非核酸检测等多个领域,为下一代分子诊断技术的发展提供了重要支撑。
通过建立通用型CRISPR检测技术平台,包括Cas酶的开发改造、检测方法迭代和配套装备研制,我们实现了高灵敏、高特异且操作便捷的分子诊断解决方案。
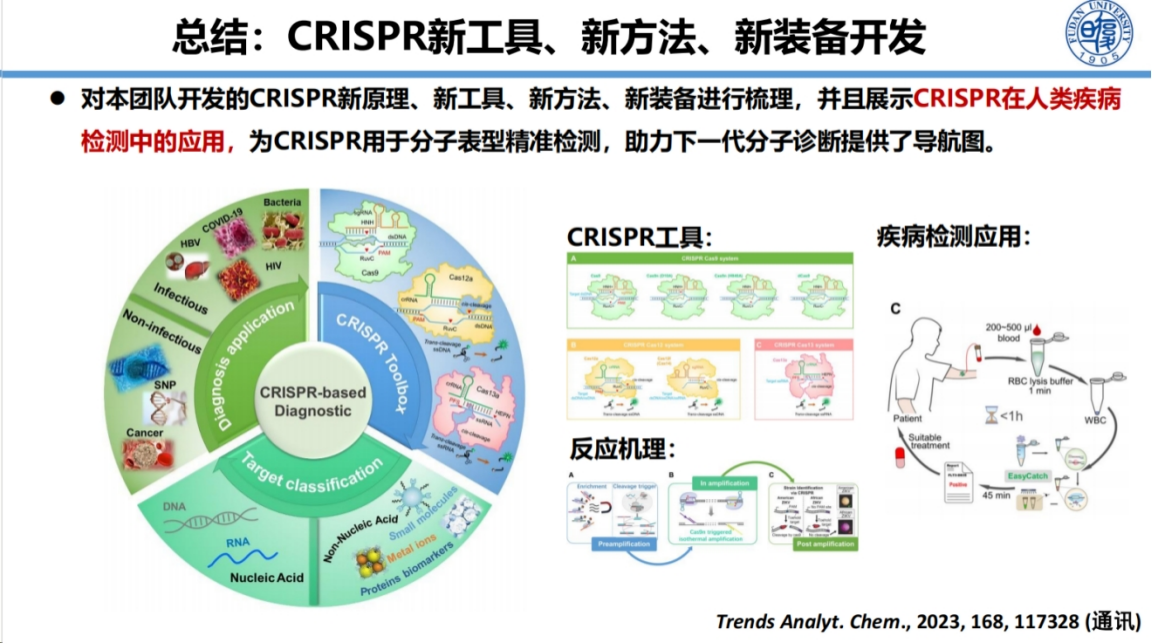
在科研转化方面,我们已开发了多项CRISPR检测试剂盒和便携装备,这些成果的科学意义在于发现创新机制、开发新型Cas酶、建立高效特异的检测方法,并通过装备创新促进多场景应用,最终服务于POCT分子诊断需求。



发表评论 取消回复