近年来,CRISPR诊断技术在非核酸检测领域应用的研究持续增加。本期介绍CRISPR应用于非核酸检测中的基本原理。并结合现有技术,探讨CRISPR可能为蛋白质检测带来哪些新的可能。

近年来,CRISPR诊断技术在非核酸检测领域应用的研究持续增加。本期介绍CRISPR应用于非核酸检测中的基本原理。并结合现有技术,探讨CRISPR可能为蛋白质检测带来哪些新的可能。
CRISPR应用于核酸检测的技术原理是:
设计针对待测靶基因的引导RNA(gRNA),Cas/gRNA复合体在gRNA引导下识别扩增的靶基因序列及靶基因原型间隔邻近域序列(PAM)激活Cas,Cas12, Cas13等Cas酶具备反式切割活性,可非特异性切割反应体系中的荧光报告分子,释放荧光信号,从而实现目标基因检测。
根据CRISPR检测原理,其反应的发生至少需要3个核心组件:
向导RNA
CRISPR-Cas蛋白(Cas12/Cas13)
可与向导RNA特异结合的目标核酸序列
CRISPR非核酸检测的基本原理也是围绕这三个关键组件进行设计的。
不同方法的检测原理和检测目标存在一定差异。
截至目前,用于检测非核酸的策略包括:适配体、DNAzymes,、核糖开关、酶促反应、转录因子、抗原-抗体相互作用、变构探针及体外转录过程。
各策略详细原理可参加文献[1]。
在此简单介绍CRISPR非核酸检测的主要设计思路:
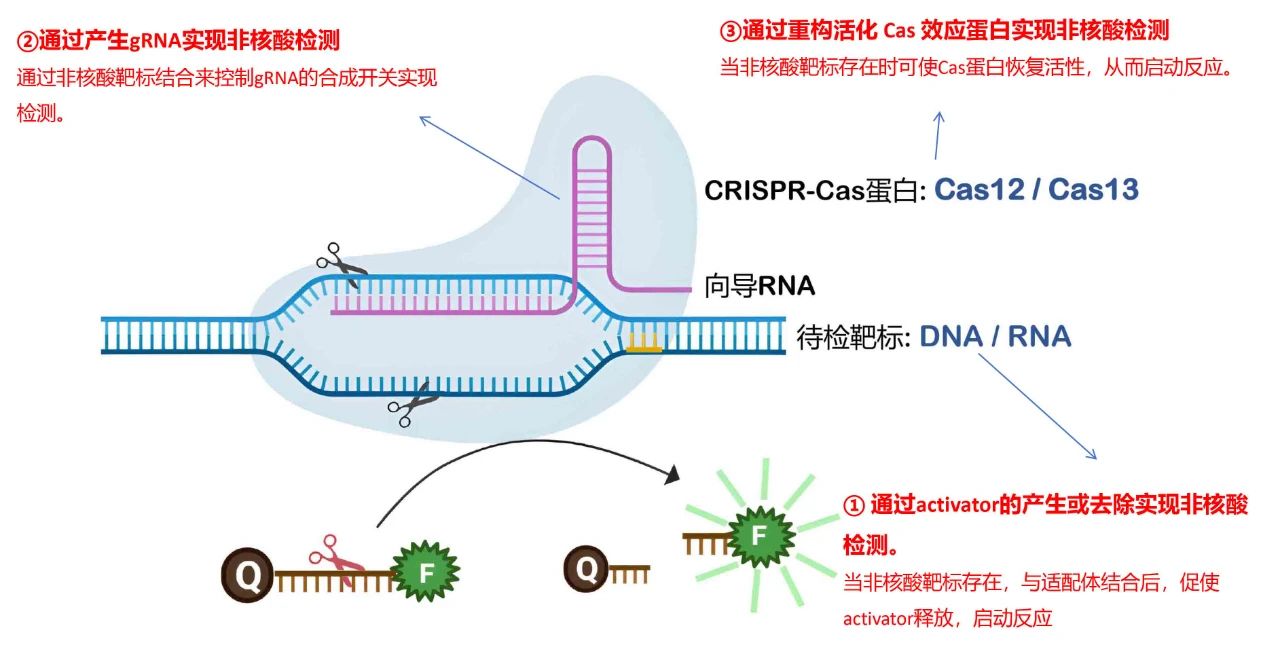
(1)通过activator的产生或去除实现非核酸检测的策略:
在CRISPR非核酸检测中,Activator是指能够触发Cas蛋白反式切割活性的核酸分子,通常为单链DNA或单链RNA。
Activator可与适配体、DNAzymes等物质结合形成复合体。
当目标非核酸物质存在时,可与复合体上的适配体、DNAzymes等结合,释放activator,游离的activator与体系中加入的gRNA、Cas蛋白反应,启动反式切割活性,产生检测信号。这是当前最常用的一种设计思路。
反过来,activator也可直接激活反式切割,产生检测信号。当目标非核酸物质存在时,可与activator复合体结合,使activator无法激活反应体系,检测信号降低。
(2)通过产生gRNA实现非核酸检测
通过靶标结合来控制gRNA的合成开关实现检测。
靶标存在时,通过酶切割等手段形成gRNA,gRNA与体系中Cas蛋白、activator结合,使Cas蛋白发挥反式切割作用,产生检测信号。
(3)通过使Cas蛋白恢复活性实现非核酸检测
Anti-CRISPR系统是病毒进化出的CRISPR-Cas活性抑制系统。
研究表明,噬菌体可通过anti-CRISPR系统对Cas蛋白进行乙酰化修饰使其失活。
细菌可进一步通过脱乙酰酶去乙酰化修饰重新激活Cas蛋白功能。
细菌去乙酰化过程中需要NAD+辅因子。因此,当检测体系中存在NAD+时可激活Cas蛋白,产生检测信号。从而实现NAD+的检测。
依据上述相关原理。科研文献研究中,CRISPR非核酸检测已应用于离子、小分子化合物、多糖、蛋白质、细胞、转录因子检测等各类物质检测。
与高效液相色谱法、气相色谱法、质谱法等方法相比,CRISPR技术无需昂贵仪器或专业操作,具备操作简便、成本低廉、便于携带等优势,在环境污染监测、疾病诊断和食品污染检测中具有重要应用潜力。
蛋白质是生命的物质基础,与各种各样的疾病息息相关。随着蛋白质组学计划的不断推进,将有更多的蛋白质标志物用于疾病的诊断与治疗中。
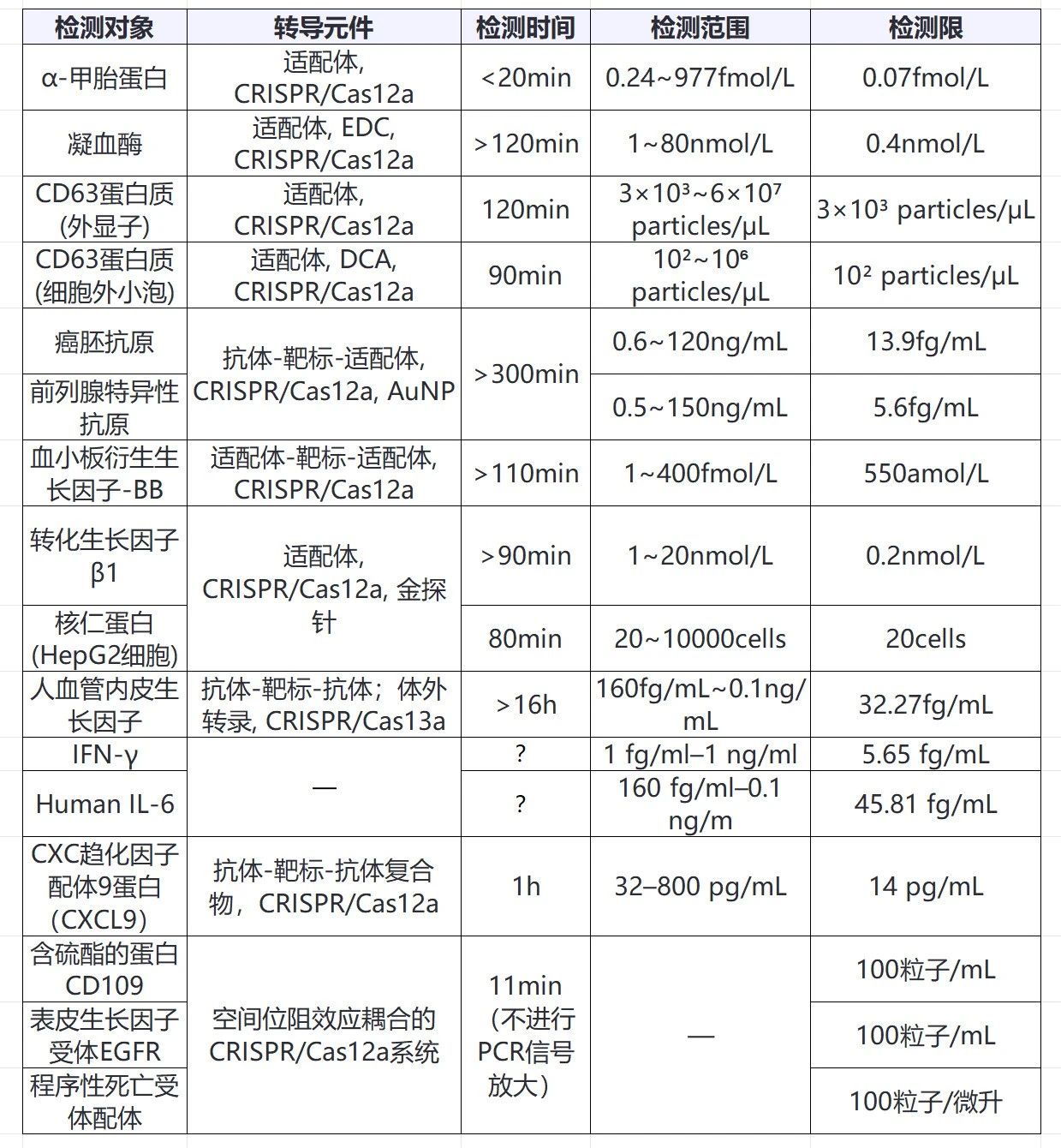
参考《CRISPR分子诊断技术原理与应用》一书及相关综述,目前CRISPR应用于各类蛋白质检测的特点如下表所示。
表1 CRISPR蛋白质检测的各种策略特点
此外,CRISPR技术也被用于酶联免疫吸附试验的信号放大。
该技术通过将生物素化双链DNA与检测抗体偶联,双链DNA将作为模板转录生成可激活Cas13a的单链RNA (activator),从而触发信号输出。其灵敏度较传统ELISA至少提升100倍。
除了应用于以上蛋白标志物和细胞因子检测外,CRISPR还可应用于多肽、蛋白酶、酶活性的检测。
在探讨CRISPR能为蛋白质检测带来哪些可能前,先来回顾一下目前常用的蛋白质检测技术。
目前广泛应用的免疫检测方法包括:酶联免疫吸附技术、荧光免疫技术、化学发光技术、胶体金技术。
其他微量蛋白质检测策略还包括:质谱技术、基于ELISA的单分子免疫阵列技术等。
四种常用技术有如下特点:
胶体金技术:简单、快速,适合自测场景,主要应用于检测具有强免疫原性的蛋白标志物(如病毒抗原)。灵敏度差,低蛋白浓度下难以检测。
酶联免疫吸附:成本低,通量大,但灵敏度低、检测耗时长。
荧光免疫技术:灵敏度高,速度快,侧重蛋白质空间定位及免疫原性蛋白检测。但存在背景干扰风险,设备依赖性强。
化学发光技术:灵敏度及特异度高、检测时间短、可定量,但设备依赖性强,成本相对较高。
以上4种技术路线各有优缺点,但在蛋白质检测上,尚难以实现通过单一技术策略兼顾产品检测性能及检测便捷性。
1、为兼顾高灵敏度、高便捷度的蛋白质POCT检测提供新的技术方向
CRISPR诊断技术用于蛋白质检测,具备高灵敏、快速及设备依赖度低的发展潜力。
如何开发一款兼具如胶体金试剂般便携、如化学发光检测般灵敏的蛋白质检测产品?
随着相关研究的不断增加、以及检测技术的不断成熟,CRISPR诊断技术可能为实现这一理想提供了新的思路。
伴随着国家基层医疗相关政策的持续推进,开发基于CRISPR的蛋白质POCT检测产品,并逐步向居家检测过渡,将可能加速蛋白质检测产品更新迭代。
2、结合现有蛋白质检测技术,承担检测信号放大的作用
PCR ELISA技术通过抗体偶联的DNA片段作为报告分子,利用抗原-抗体特异性结合形成复合物后,对结合DNA进行PCR扩增,指数级放大检测信号,大大提升检测灵敏度。
CRISPR技术与ELISA技术结合,也可实现检测信号放大(见本文第2部分)。与以上PCR ELISA技术相比,CRISPR更可能带来无需变温PCR仪,不产生核酸气溶胶的优势。
未来,随着CRISPR诊断酶价格的不断降低,CRISPR有潜力成为微量蛋白质检测的新兴技术方向。
总之,尽管CRISPR在蛋白质检测中的应用仍处于研究阶段,但其技术本身可能为蛋白质检测带来的高灵敏度与高便捷性仍值得关注。也许在不久的将来,CRISPR也能为微量蛋白标志物检测走入基层提供技术支撑。
参考文献:
[1]Zhang S, Xu D, Li F, Wang J. CRISPR-based non-nucleic acid detection. Trends Biotechnol. 2025 May 14:S0167-7799(25)00139-8.
[2] 李越希、童贻刚主编,CRISPR 分子诊断技术原理及应用。





发表评论 取消回复