2025年6月7日,由中国医药生物技术协会生物诊断技术分会主办,首期“生物诊断前沿技术专题会”在北京亦庄生物医药园召开。专题会聚焦《CRISPR诊断技术的创新与转化》。


2025年6月7日,由中国医药生物技术协会生物诊断技术分会主办,首期“生物诊断前沿技术专题会”在北京亦庄生物医药园召开。专题会聚焦《CRISPR诊断技术的创新与转化》。
生物诊断公众号将对各专家汇报内容进行汇编整理,供关注CRISPR诊断技术的业内同仁学习参考。
本期分享中国科学院苏州生物医学工程技术研究所缪鹏教授报告:《基于CRISPR/DNA纳米技术的电化学分子诊断》。


目前CRISPR检测方法中,主要采用荧光检测技术。我们选择开展电化学分子诊断研究是基于以下考虑:
相比于荧光光谱仪,电化学工作站具有较大的价格优势;
电化学工作站规避了光路的设计,系统整体鲁棒性更高。
电化学分子诊断技术具有其独特的技术优势,下面我将具体汇报我们的研究工作。
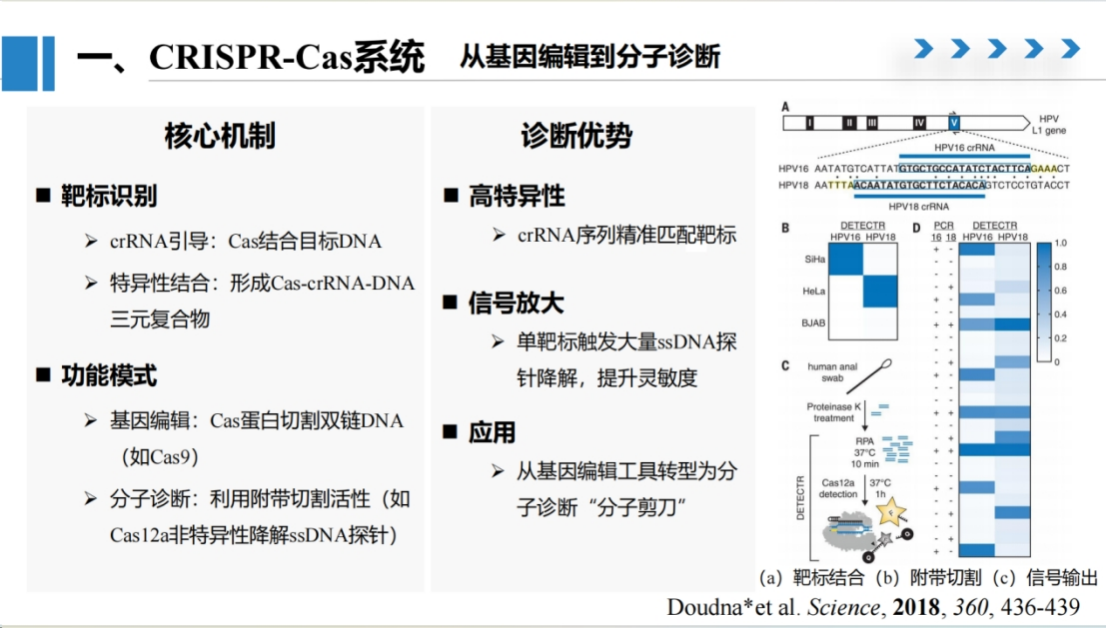
CRISPR-Cas系统方面,之前两位老师已经进行了详细介绍。
我们的研究主要将CRISPR系统作为一种工具应用于检测设计。
CRISPR系统具有两大核心功能:基因编辑功能和反式切割活性。我们的研究聚焦于利用其反式切割活性进行分子诊断,将其作为检测工具的核心组件。
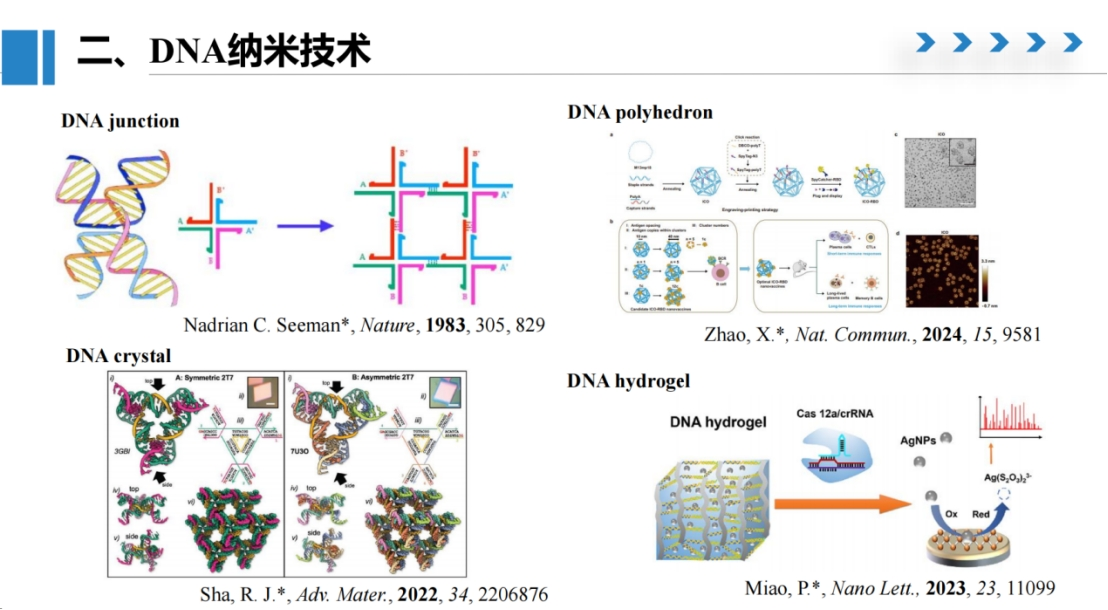
DNA纳米技术与CRISPR系统都与核酸分子具有天然的紧密联系。
DNA纳米技术由纽约大学的Seeman教授于1983年首次提出。
他在《Nature》发表的开创性工作中,仿照生物体内的Holliday junction结构,设计出四通节的J1 junction,形成稳定的核酸构象。
通过在junction上设计互补序列,可以实现核酸链的相互杂交,构建二维平面结构。Seeman教授团队后续还将平面杂交扩展应用于DNA晶体的构建,在结构设计方面取得了诸多创新成果。
DNA多面体的设计与应用也受到了研究人员的关注。
去年聂广军团队基于DNA二十面体发展了新型分子疫苗的研究。
我们还可以将DNA纳米结构从微观尺度扩展到宏观尺度,制备成水凝胶形态,直观观察其相分离和相变状态,并通过这种状态变化引发电化学信号的读取。

上海交通大学樊春海院士提出了"框架核酸"的新概念,对DNA结构进行了重新定义。
框架核酸可以将DNA设计成具有特定功能的生物材料。
传统上,DNA主要被视为遗传信息的载体;而框架核酸则可被赋予类似抗体或其他生物活性材料的功能特性。
通过对框架核酸进行修饰和设计,可以赋予其特定的力学、光学或电学性质,从而有效服务于各类应用目标。
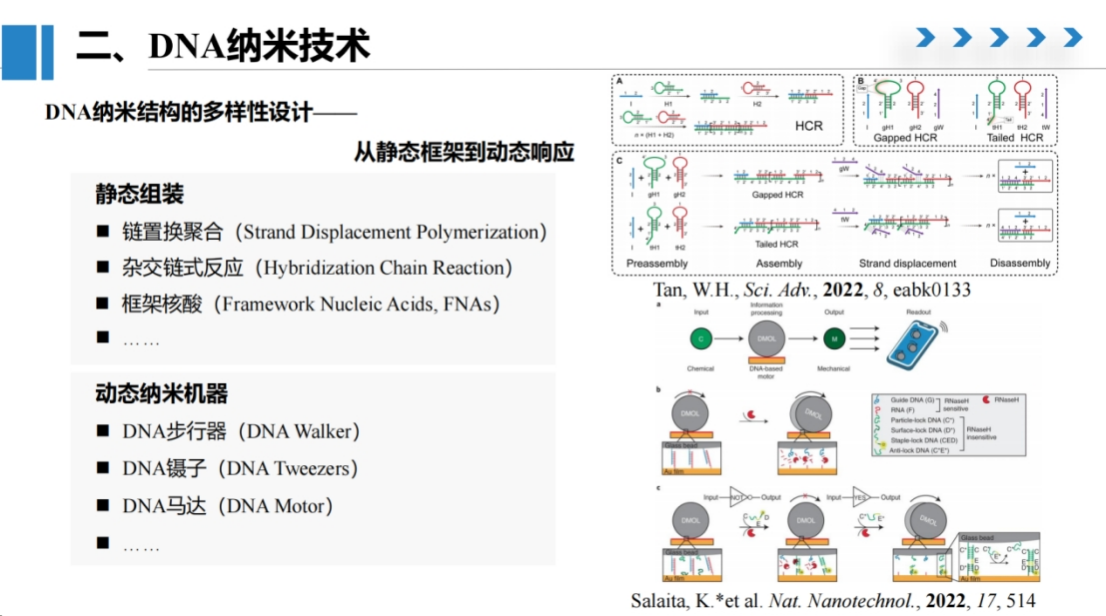
本次报告介绍了基于CRISPR/DNA纳米技术的电化学分子诊断方法。
重点阐述了其在检测技术方面的优势和发展潜力。
探讨了DNA纳米技术在微观和宏观尺度上的应用,以及如何将其作为生物活性材料服务于各种目标。
DNA纳米结构具有多样化的设计潜力,既可用于静态组装,也可实现动态调控。
在静态组装方面,我们可以通过设计特定序列实现链置换反应和杂交链反应,构建不同框架的核酸结构。
在动态调控方面,可以设计DNA步行器、DNA马达等分子反应器,既能在静态条件下观察最终形成的结构状态,也能在预设轨道上进行动态分子反应。
这些特性均可作为分子诊断中的信号放大元件,我们课题组在此领域开展了大量研究工作。
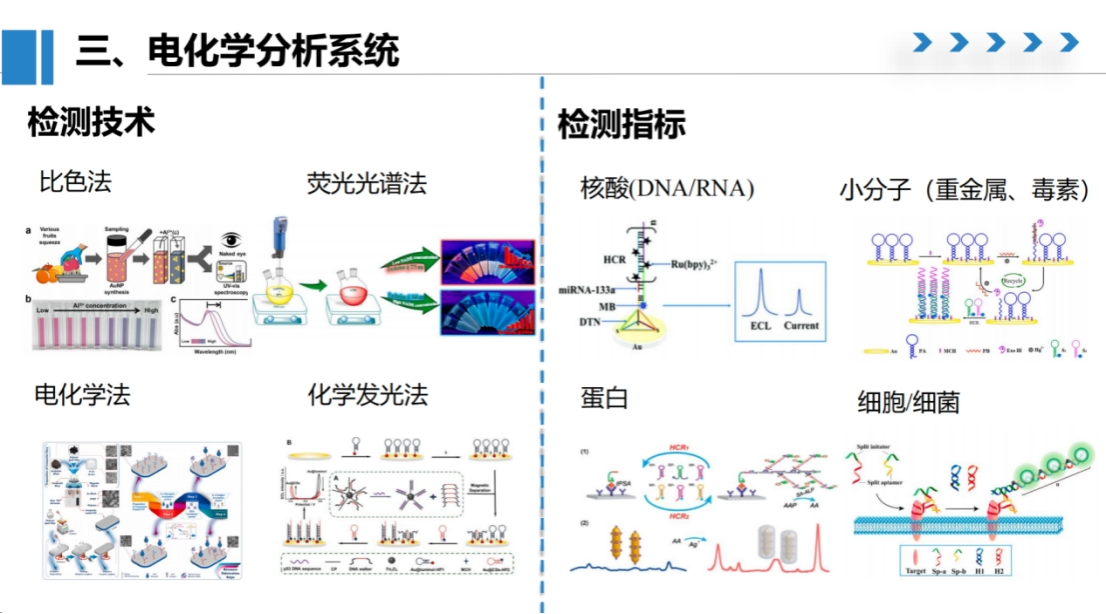
近年来,CRISPR技术快速发展,我们将其与DNA纳米技术相结合,开展了多学科交叉研究,构建了新型生物传感器。
在信号输出技术选择方面,电化学分析系统具有独特优势。
虽然比色法、荧光光谱法和电化学发光法等在医院中应用广泛,但电化学检测在成本效益和操作便捷性方面表现突出。

电化学检测的基本原理是通过测量电流、电压或阻抗等物理参数实现检测。
在电极修饰方面,我们基于DNA纳米技术,在电极表面构建了多种DNA纳米结构作为信号探针。
与荧光检测常用的有机染料或量子点不同,电化学检测采用特定的电化学活性物质作为探针。我们自主研发的纳米探针具有优异的电化学反应特性,可实现高效信号检测。
在信号放大策略方面,我们整合了电置换聚合反应、LAMP扩增技术以及CRISPR系统的信号放大功能。
通过这种技术整合,我们能够检测包括核酸、小分子、蛋白质和细胞等多种低丰度生物标志物。
目前研究重点集中在癌症肿瘤标志物检测,特别是循环肿瘤DNA(ctDNA)和microRNA等分子。
研究1:基于链置换聚合反应的miRNA电化学传感器
自1993年首次发现以来,microRNA在肿瘤早期诊断中的重要性日益凸显。
其在不同分型中的表达量变化具有重要诊断价值,但由于丰度低、长度短,传统PCR方法在序列设计上面临挑战。
为此,我们开发了基于链置换聚合反应的miRNA电化学传感器,结合CRISPR/Cas技术实现信号放大。
该传感器的核心设计包括:
首先构建特异性颈环结构,其loop区可与目标miRNA杂交并打开颈环;
其次利用回文序列特性使两个颈环探针形成二聚体;
最后通过DNA聚合酶延伸形成完整双链DNA。
这一创新设计有效解决了microRNA检测的技术难题,为肿瘤早期诊断提供了新工具。
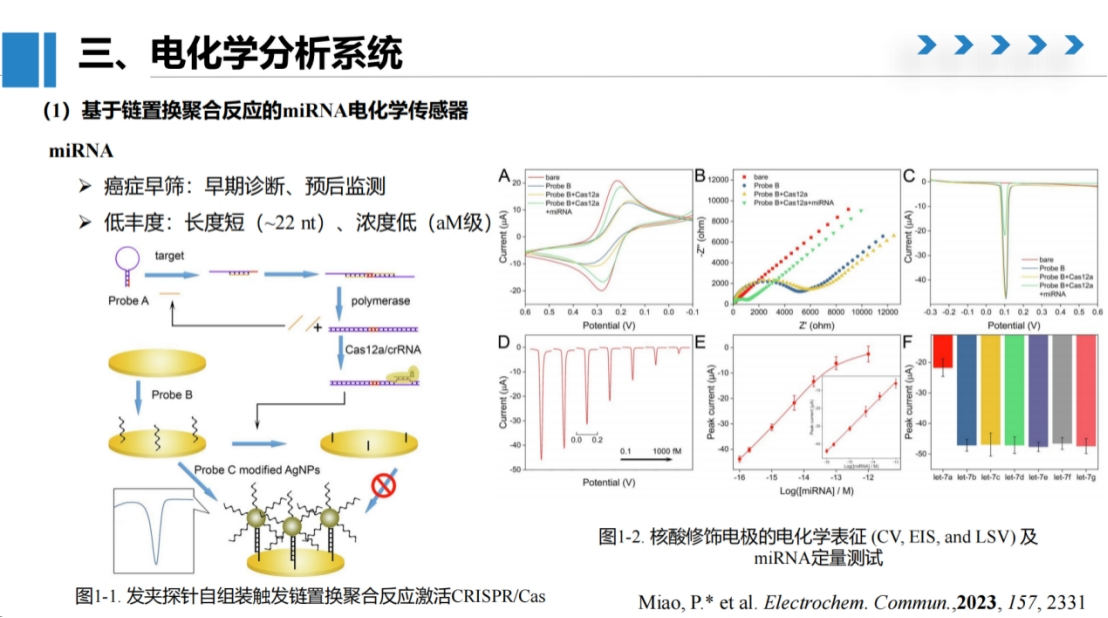
在miRNA检测方法的研究中,我们开发了一种创新的电化学检测策略:
该策略的核心在于利用双链DNA作为中间产物,通过链置换反应实现目标miRNA的循环扩增。
具体而言,当双链DNA形成后,可以置换出初始的miRNA分子,使其能够继续与体系中的其他颈环结构探针A发生反应,从而实现目标循环扩增过程。通过这一机制,我们能够获得大量的双链DNA产物。
这些双链DNA产物可与Cas12a/crRNA复合物特异性结合,进而激活Cas12a蛋白的反式切割活性。
在实验设计中,我们将DNA探针修饰在电极表面。当Cas12a的反式切割活性被激活后,能够有效切割电极表面的单链DNA,使其无法通过互补配对的方式捕获预先合成的纳米颗粒电化学信号分子。
这一过程最终导致电信号的显著改变,从而实现对原始miRNA浓度的定量分析。
我们采用多种电化学技术对系统性能进行了全面测试:
循环伏安测试结果显示:裸电极表现出较高的氧化还原峰电流,表明其具有良好的导电性能;
当修饰单链DNA后,由于DNA磷酸骨架的高密度负电性会排斥电解液中的铁氰化钾信号分子,导致峰电流明显下降;
加入Cas12a蛋白但未激活时,峰电流无明显变化,证实Cas12a在未激活状态下不具备切割活性;
而在加入miRNA及聚合酶反应体系后,氧化还原峰电流得到显著恢复,证明电极表面的单链DNA已被有效切割。交流阻抗测试进一步清晰地展示了电极表面阻抗的变化特征。
在信号输出方面,我们选用银纳米颗粒作为溶出伏安法的信号分子。与传统定向分子相比,我们合成的银纳米颗粒具有更窄的半峰宽,非常适合定量分析。
实验结果显示,在完成化学反应后,电流值明显下降,表明电极表面已无法通过互补配对固定银纳米颗粒。
定量实验表明,在0.1-1000 fM的浓度范围内,银纳米颗粒的溶出伏安曲线峰值与miRNA浓度呈良好的线性关系。
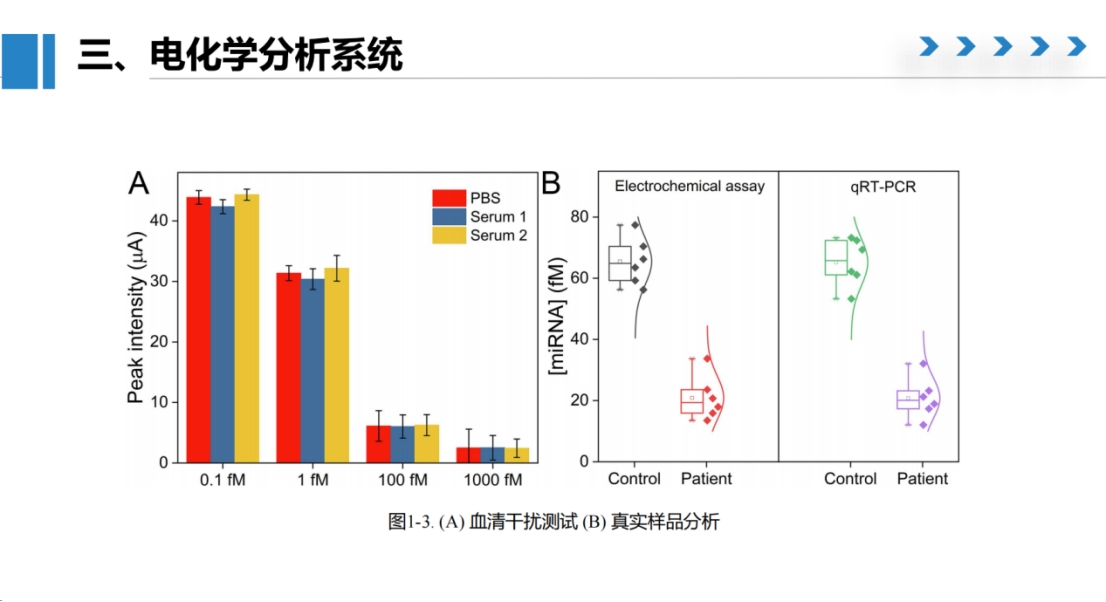
该方法展现出优异的选择性。
当检测目标序列及其同家族miRNA时,只有完全匹配的序列才会引起明显的电流变化。在血清样本的加标实验中,经过适当稀释的血清样本与PBS缓冲液的检测结果基本一致。
此外,我们对健康人和肿瘤患者的血清样本进行了检测,结果显示该方法能够有效区分这两类人群,且与qPCR检测结果具有高度一致性。
研究2:基于DNA水凝胶与单颗粒碰撞的miRNA电化学传感器
在第二个研究中,我们采用了DNA水凝胶材料和单颗粒碰撞效应来改进检测方法。
不同于传统依赖电流峰值强度的定量方式,单颗粒碰撞技术通过记录碰撞频率作为定量参数,有效规避了环境电场等因素的干扰,显著提高了检测的可靠性。
这一创新方法为miRNA检测提供了新的技术路径。
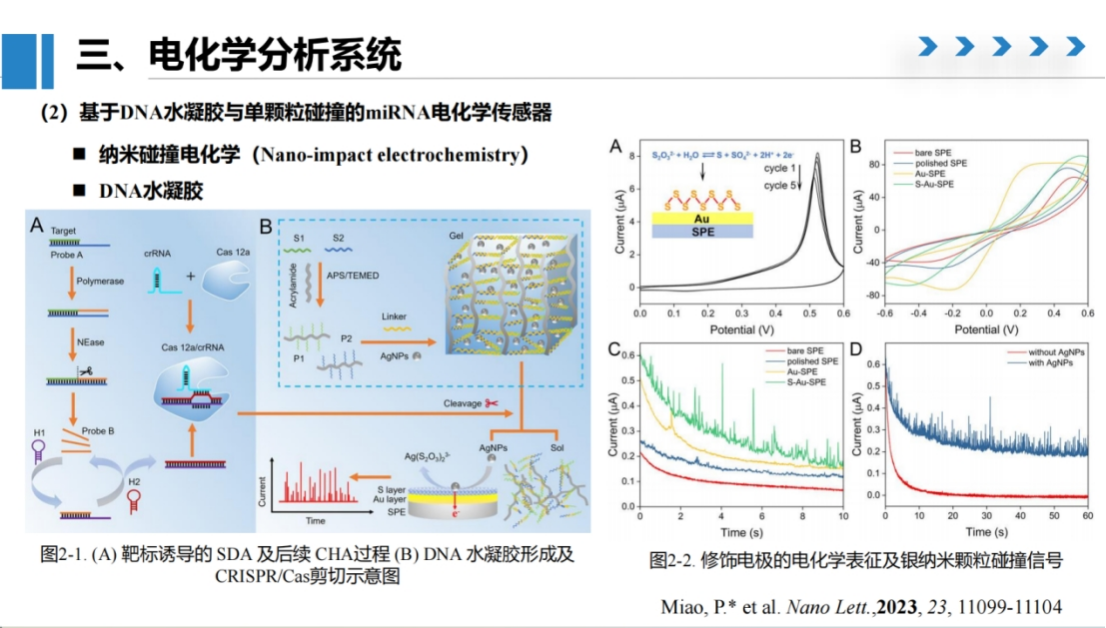
该方法的核心设计是将银纳米颗粒包裹在DNA水凝胶中,通过miRNA触发的级联反应释放纳米颗粒,最终通过记录纳米颗粒与电极的碰撞频率实现定量分析。
具体而言,我们在聚丙烯酰胺末端修饰不同DNA序列,通过linker链的互补配对形成水凝胶结构,并将银纳米颗粒包裹其中。当体系不存在目标miRNA时,水凝胶保持完整状态,不会产生碰撞信号。
检测过程涉及多步分子反应:
目标miRNA首先与探针A杂交,在聚合酶作用下延伸;
随后加入切刻内切酶(NEase),在聚合酶作用下产生大量探针B;
探针B与设计的颈环结构H1、H2发生催化发夹组装反应,生成的双链DNA可激活Cas12a的反式切割活性;
Cas12a切割linker链导致水凝胶水解,释放包裹的银纳米颗粒。
释放的银纳米颗粒在丝网印刷电极表面发生碰撞,产生可检测的电流脉冲信号。
通过统计碰撞频率即可实现对miRNA的定量分析。
为提高检测灵敏度,我们对电极表面进行了优化处理:
首先在碳电极表面修饰金层,再修饰多硫化物层。如下图C所示,这种修饰方式显著提高了信号的分辨率。
对比实验表明(图D),存在银纳米颗粒时碰撞频率显著高于对照组,验证了方法的特异性。通过聚丙烯酰胺凝胶电泳证实了DNA杂交过程的正确性。
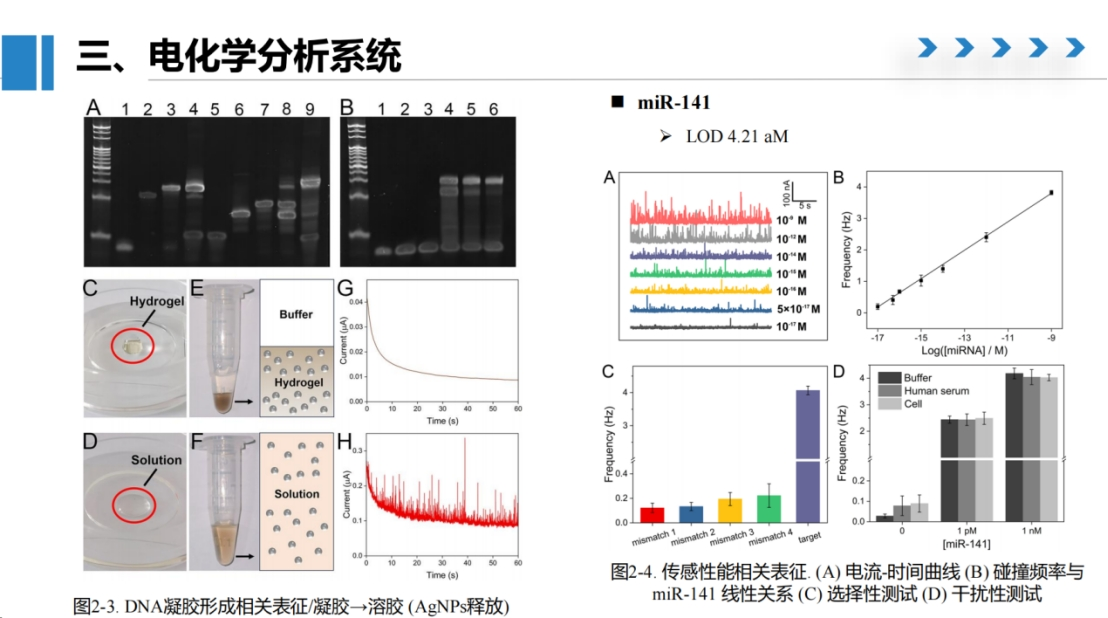
水凝胶的状态变化可通过肉眼观察:未水解的水凝胶在buffer中呈现明显分层,而经miRNA触发Cas12a切割后,溶液与buffer完全混匀。
该方法检测灵敏度可达10 amol,并成功应用于错配序列鉴别及血清、细胞样本测试。
研究3:基于MnO2纳米片修饰电极的GSH电化学传感器
第三项研究聚焦于谷胱甘肽(GSH)检测。
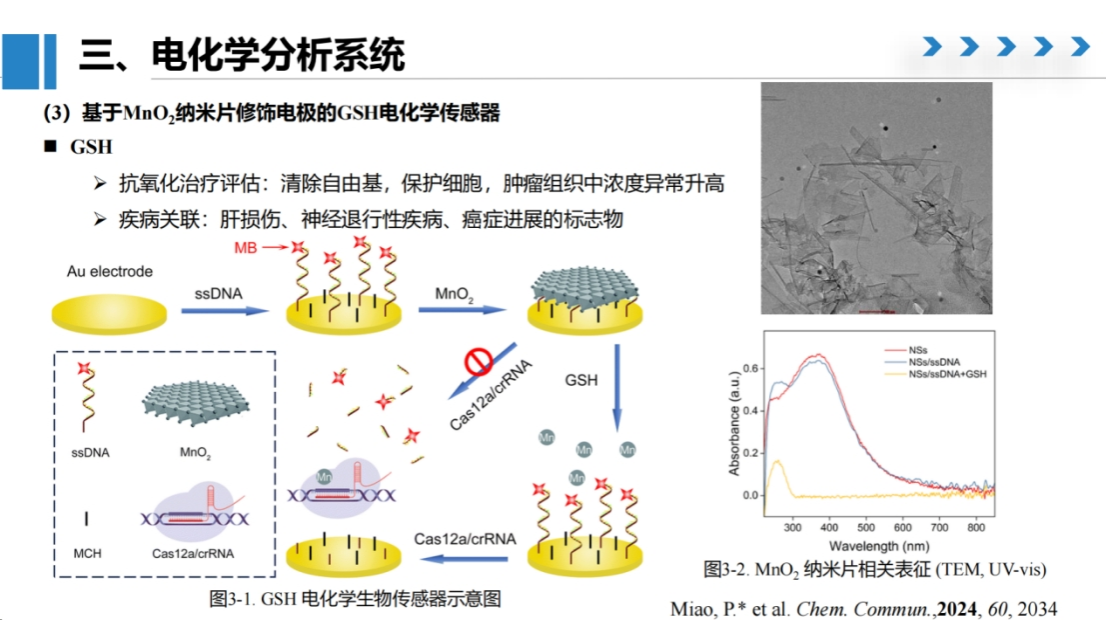
GSH作为细胞内高浓度的含巯基抗氧化多肽,在肿瘤细胞中过表达。
我们在静电极表面修饰单链DNA,末端标记电化学信号分子,并利用二氧化锰纳米片与单链DNA的强吸附作用屏蔽Cas酶对DNA的降解。
当体系中存在GSH时,可将二氧化锰纳米片还原为锰离子,解除屏蔽作用的同时增强Cas酶活性,从而实现对GSH的定量检测。
该方法通过监测纳米片消失和反应速率变化实现高灵敏度检测。
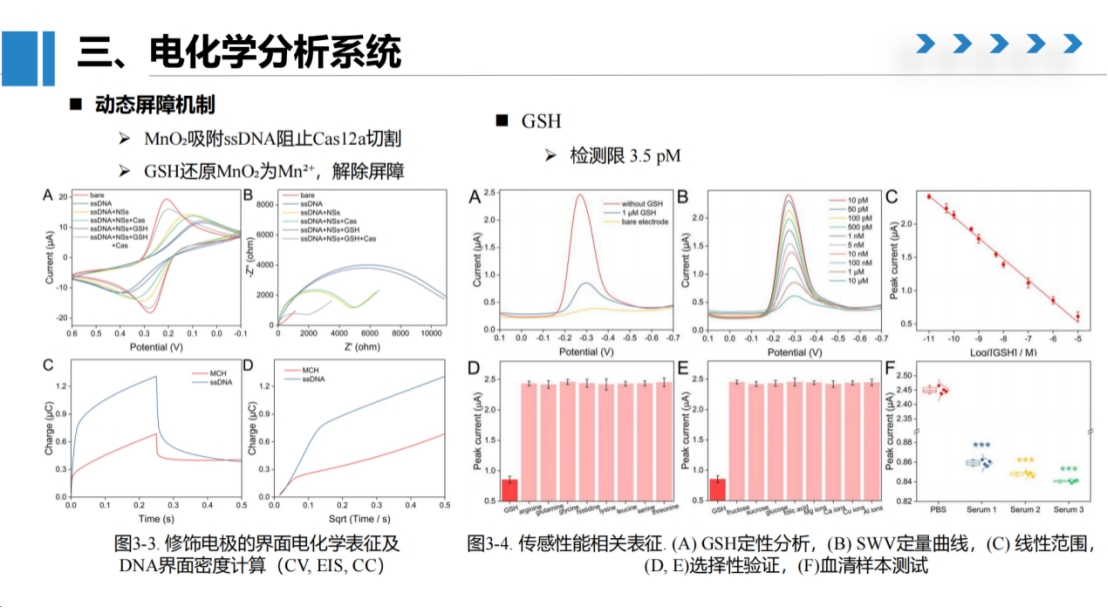
本研究通过电化学方法对谷胱甘肽(GSH)检测系统进行了全面测试。
实验结果表明,该系统的检测限为3.5 pM,虽然灵敏度相对有限,但由于生物样本中GSH的正常浓度范围在微摩尔至毫摩尔级别,这一检测限完全满足临床和生物检测需求。
在选择性测试中,仅当GSH存在时才能观察到明显的电流值下降,表明Cas酶切割反应具有高度特异性,能够有效区分GSH与其他氨基酸或生物活性分子。
研究4:基于多孔氧化铁的FEN1自供能生物传感器
在第四项研究中,我们开发了一种基于自供能生物传感器的FEN1蛋白分析方法。
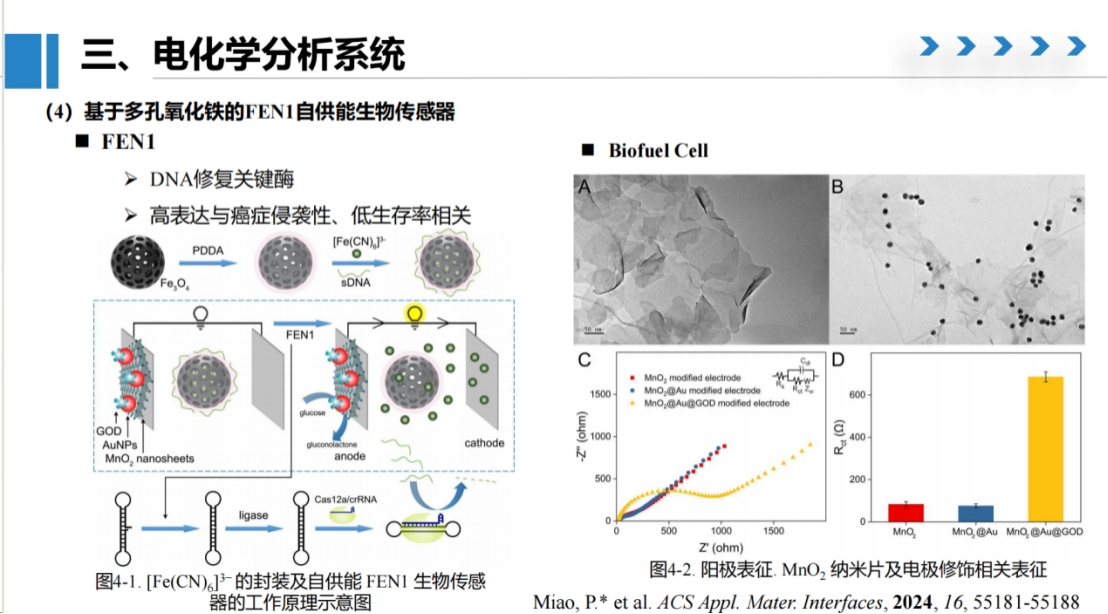
该方法借鉴了生物燃料电池的设计思路,采用哑铃型DNA探针作为检测核心。该探针的5'端和3'端均设计有突出序列,其中5'端的flag序列可被FEN1特异性识别并切割,形成平末端结构。在DNA连接酶作用下,平末端可连接形成完整双链DNA,进而与crRNA结合并激活Cas酶活性。
我们合成了具有多孔结构的四氧化三铁纳米材料,并将铁氰化钾分子封装其中,外层采用单链DNA进行包裹封闭。
在电极系统设计中,阳极和阴极均采用ITO电极,阳极表面依次修饰氧化镁纳米片、金纳米颗粒和葡萄糖氧化酶。
初始状态下,由于铁氰化钾被封闭在多孔材料内部,系统开路电压极低,难以产生有效电流。
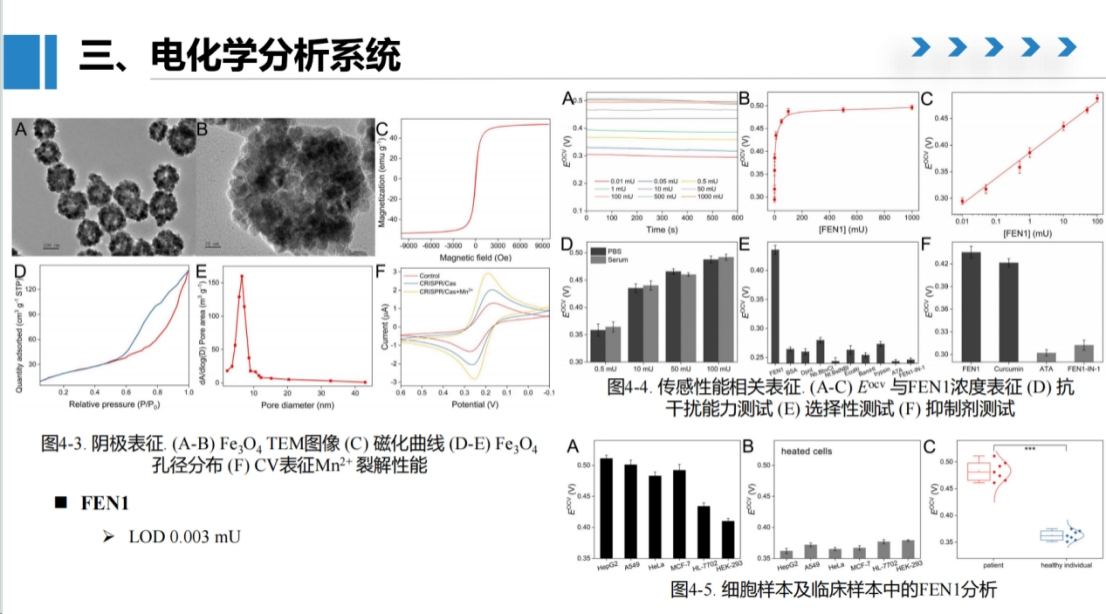
当FEN1激活Cas酶活性后,Cas酶可降解包裹纳米材料的单链DNA,释放内部封装的铁氰化钾分子,从而显著提高系统的开路电压。
通过测量开路电压的变化,可实现对FEN1活性的定量表征。
电镜表征显示,合成的氧化铁纳米材料具有典型的疏松多孔结构,孔径分布在几个纳米范围内,能够有效吸附铁氰化钾信号分子。磁性测试证实该材料具有良好的磁学性能。
该方法检测灵敏度可达0.003 mU,并成功应用于临床样本分析。
对比健康人和患者样本的测试结果表明,该方法能够清晰区分不同人群的FEN1表达水平差异,展现出良好的临床应用潜力。
研究5:基于框架核酸结构的液滴发电机传感器
第五项研究基于四面体框架核酸结构,开发了液滴发电机传感器。
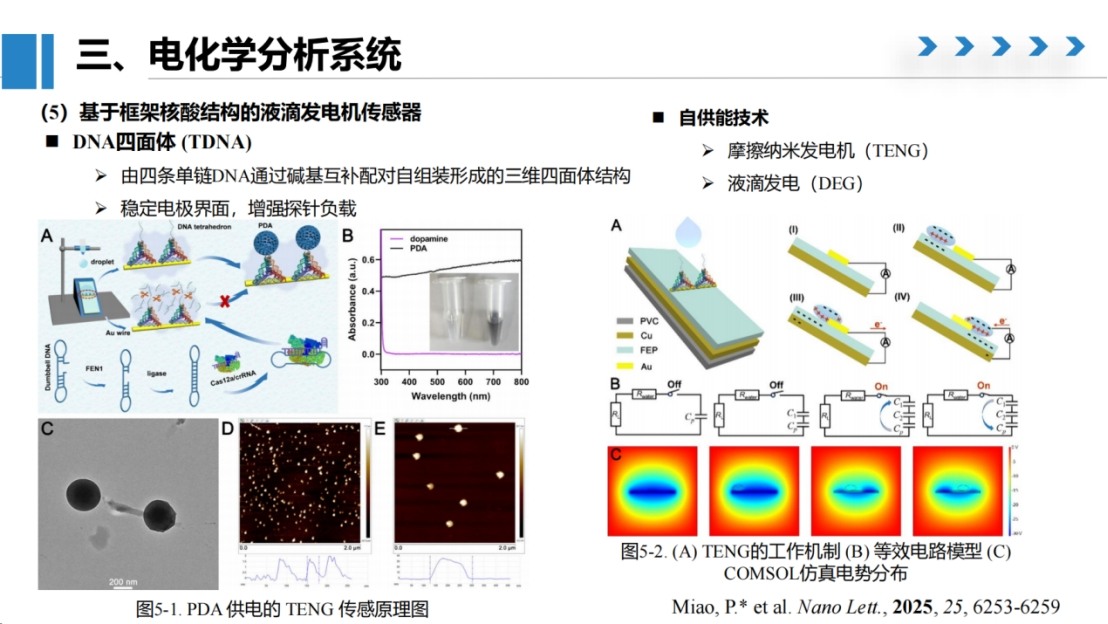
该设计利用四条单链DNA自组装形成具有六条棱边的四面体结构,并在顶端设计单链区域用于捕获聚多巴胺纳米颗粒。这种具有摩擦电特性的纳米材料与Cas酶切割活性相结合,为新型生物传感器的开发提供了创新思路。
本研究创新性地将摩擦纳米发电机技术应用于生物传感领域。
该技术基于王中林院士提出的液滴发电原理,通过将液滴动能转化为电能实现信号输出。
具体而言,我们设计了一个斜坡结构,使纯水滴落时与修饰的金线接触产生电荷分离。当金线表面修饰聚多巴胺(PDA)材料时,由于其优异的电荷屏蔽性能,可显著改变电流输出信号。
PDA的捕获过程通过目标蛋白FEN1的表达水平进行调控。其原理与前述研究类似,通过哑铃结构识别激活Cas酶,切割四面体顶端的单链DNA序列,从而抑制PDA的吸附能力。通过测量液滴发电电流值的降低程度,可以建立与FEN1浓度的定量关系。
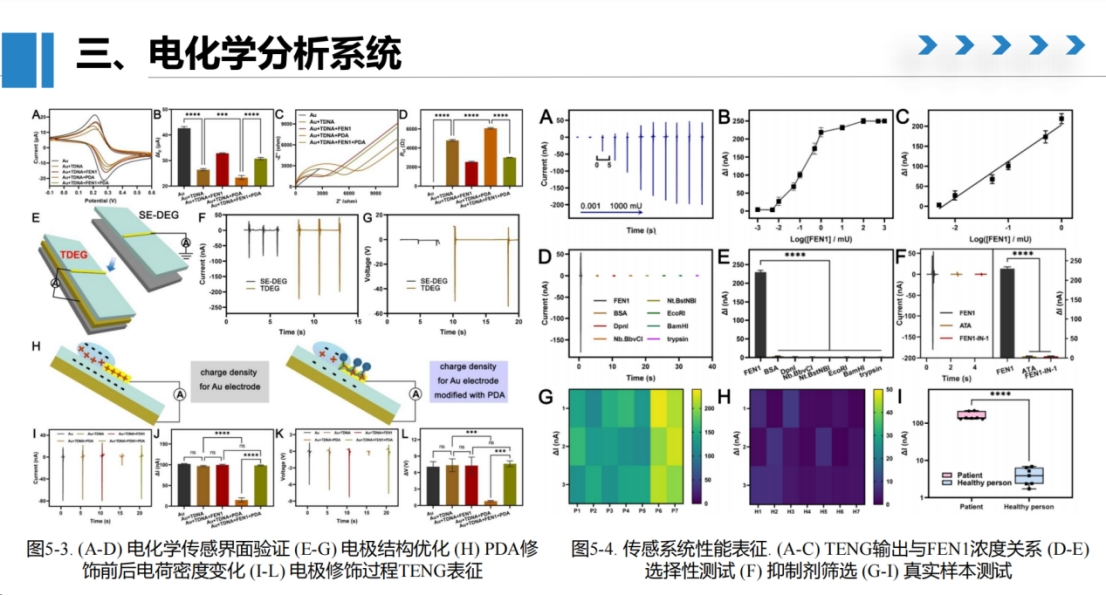
材料表征结果显示,合成的PDA纳米颗粒尺寸约为200-300纳米(图C),与冷冻电镜观察结果一致(图E)。四面体纳米结构成功修饰在膜表面(图D),并能够有效捕获PDA纳米颗粒(图E)。
通过优化液滴发电参数,在0.001-1000 mU浓度范围内建立了良好的线性响应关系(图A)。
选择性实验证实,该方法对FEN1检测具有高度特异性,常见干扰物不会影响检测结果(图E)。
此外,研究还验证了两种FEN1抑制剂(ATA和FEN1-IN-1)的抑制效果(图F)。
临床样本测试表明,患者组FEN1表达水平显著高于健康对照组(图G、H),展现出良好的临床应用潜力。热图分析直观展示了这一差异特征。
综上所述,本研究成功将CRISPR/Cas技术、DNA纳米技术与电分析方法相结合,实现了高特异性识别与高灵敏度检测。
通过整合自供电系统和液滴发电等创新技术,为多场景应用提供了新的解决方案。
特别是将电化学传感与微流控技术相结合,有望开发出新型POCT设备,有效降低对专业设备和资源的依赖,推动便携式医疗设备的发展。
最后,衷心感谢所有合作团队对本研究的贡献,同时感谢各项科研基金的资助支持。





发表评论 取消回复