2025年6月7日,由中国医药生物技术协会生物诊断技术分会主办,首期“生物诊断前沿技术专题会”在北京亦庄生物医药园召开。


2025年6月7日,由中国医药生物技术协会生物诊断技术分会主办,首期“生物诊断前沿技术专题会”在北京亦庄生物医药园召开。专题会聚焦《CRISPR诊断技术的创新与转化》。
生物诊断公众号将对各专家汇报内容进行汇编整理,供关注CRISPR诊断技术的业内同仁学习参考。
本期分享同泽合信(北京)医药科技有限公司医学总监屈悦报告:《CRISPR诊断技术如何闯过研发到上市的“三重关卡”》。


尽管全球CRISPR诊断产品商业化仍处早期,目前国内获批上市产品仅有两款,但这一主题的探讨对于技术创新转化具有重要借鉴意义。
同泽合信公司自2017年成立以来,一直专注于体外诊断领域的产品转化服务,成功推动了多个创新医疗器械产品的认定,以及多个同品种首个产品成功上市。


这次分享的主题是:CRISPR诊断技术如何闯过研发到上市的“三重关卡”。
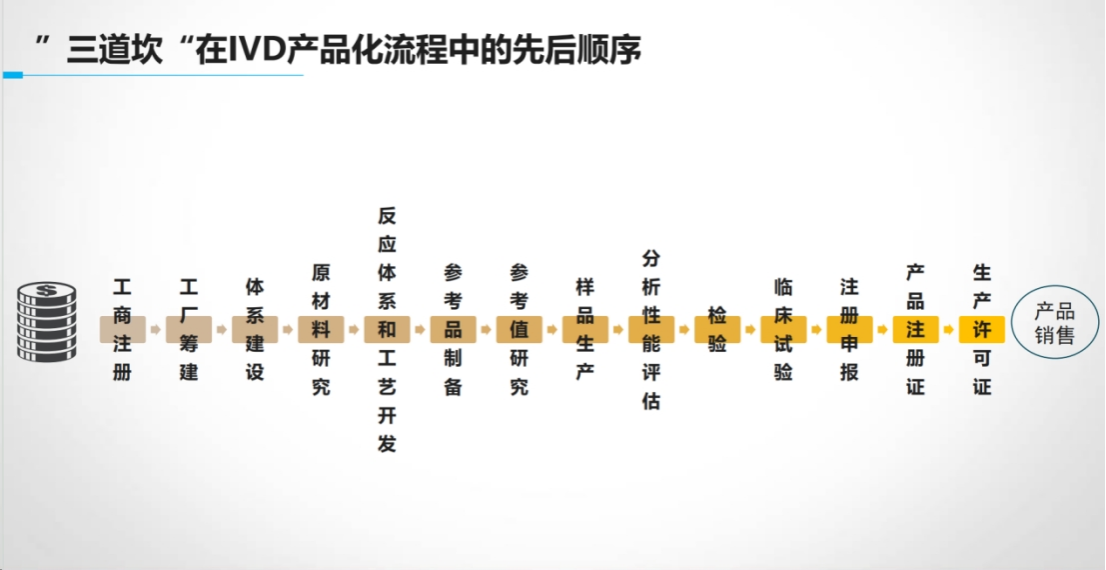
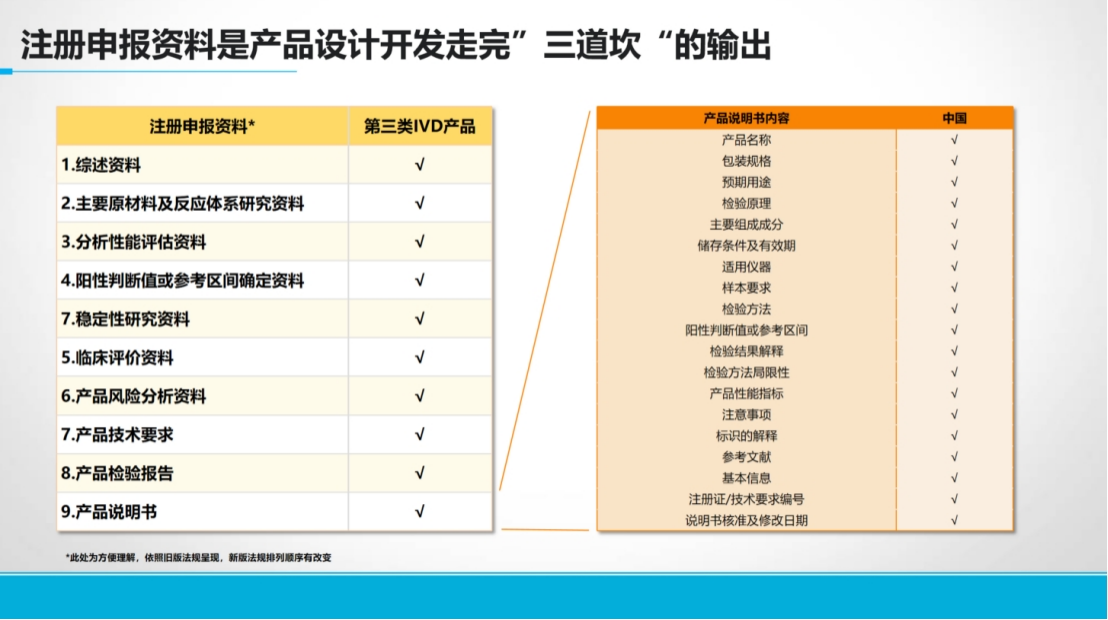
任何IVD新产品的上市都需要满足技术端和应用端的共同期望,而这一过程需要跨越三个关键证据环节:
首先是分析物的科学有效性证据。
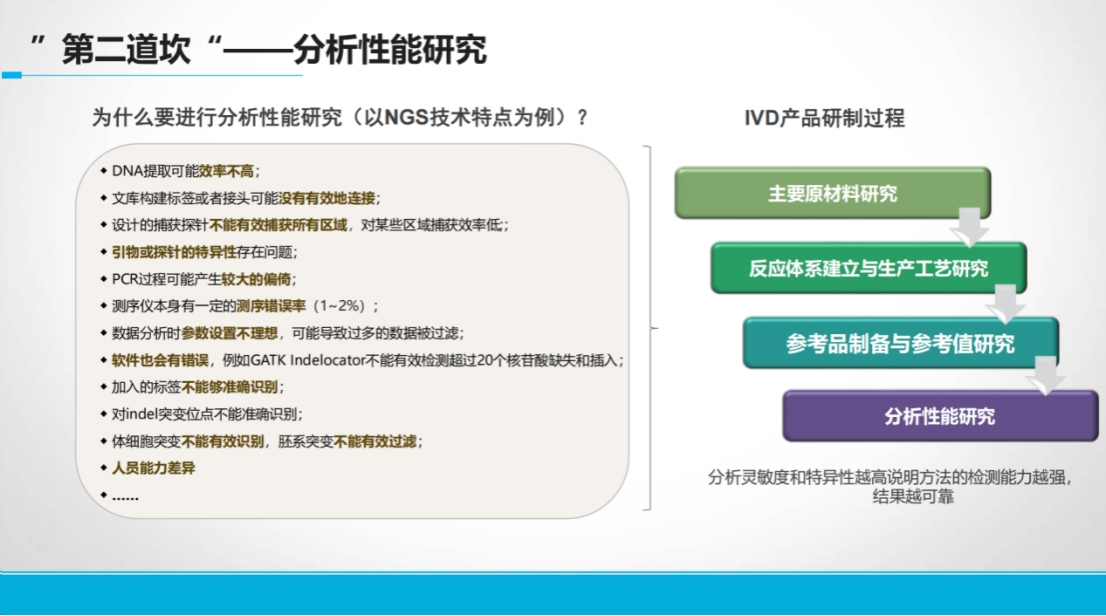
其次是分析性能研究证据。
最后是临床性能研究证据。

核心在于证明分析物与临床状态的相关性。成熟分析物可借力现有证据,但全新靶标需提供指南/共识/文献支撑。
一个容易“不小心犯错”的误区是简单组合已验证靶标——例如将上/下呼吸道病原体检测捆绑,却忽略样本类型和人群差异。
Tips:有效性评估需综合样本类型、适用人群等多项产品要素。

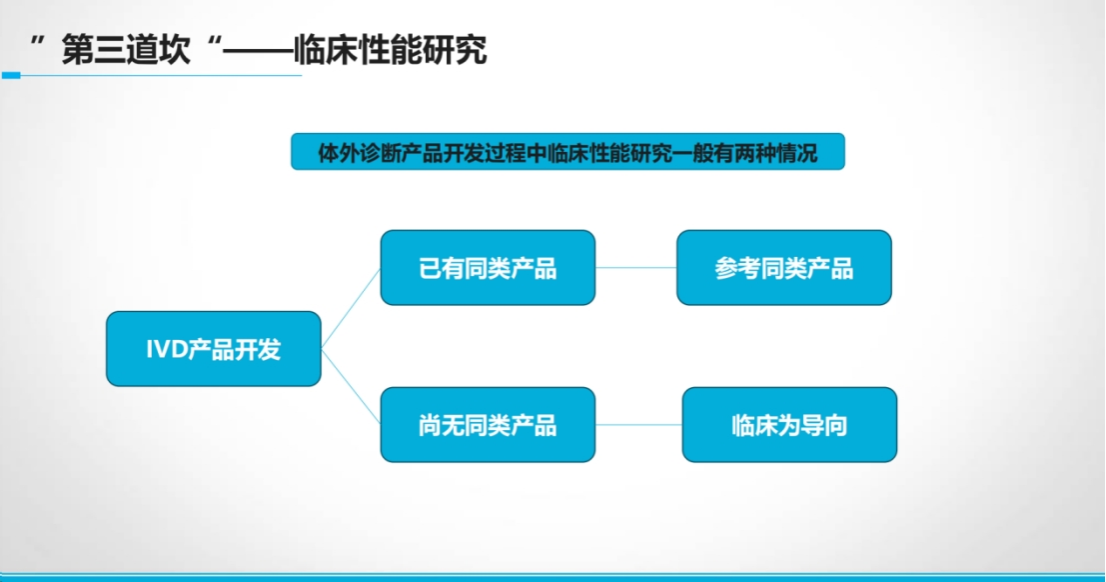
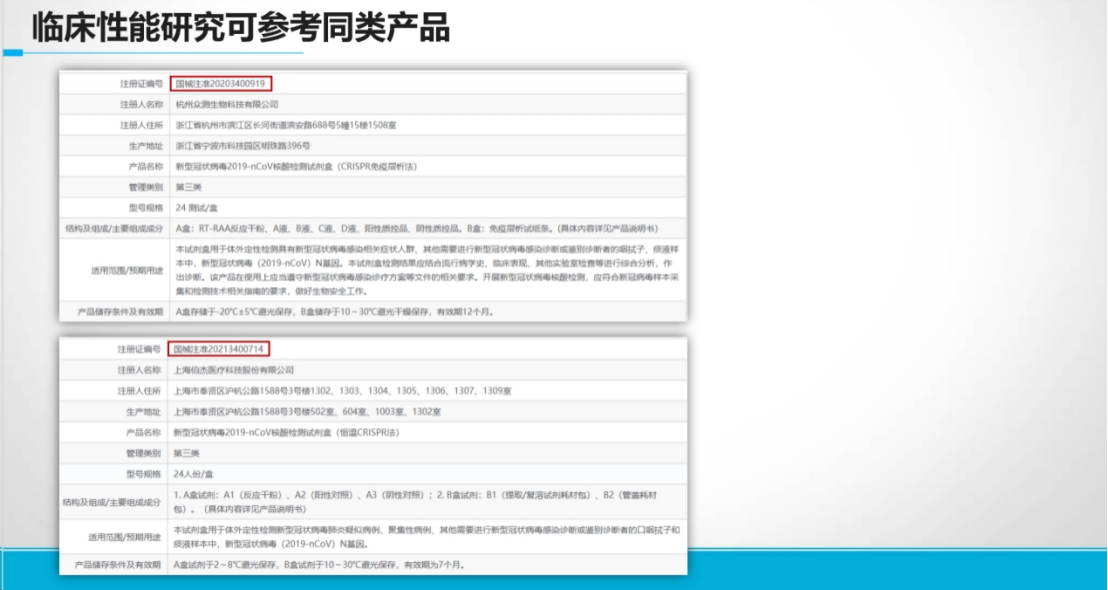

情景2:无同类产品(创新破局点)
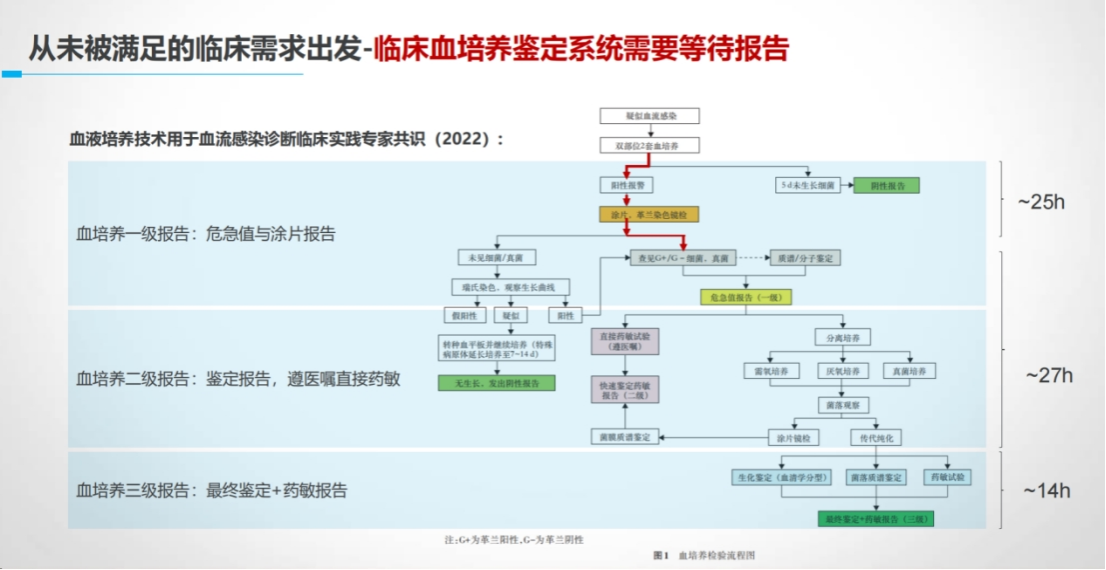
▶ 案例1:数字PCR血流感染检测
传统血培养阳性率仅8%-12%,且耗时长。
数字PCR四联检方案虽灵敏度提升,但以血培养为参照时特异性指标“表现不佳”(CI下限<90%)。
通过多维度证据链证明:不符数据存在血培养漏检情况,反向验证新技术价值。



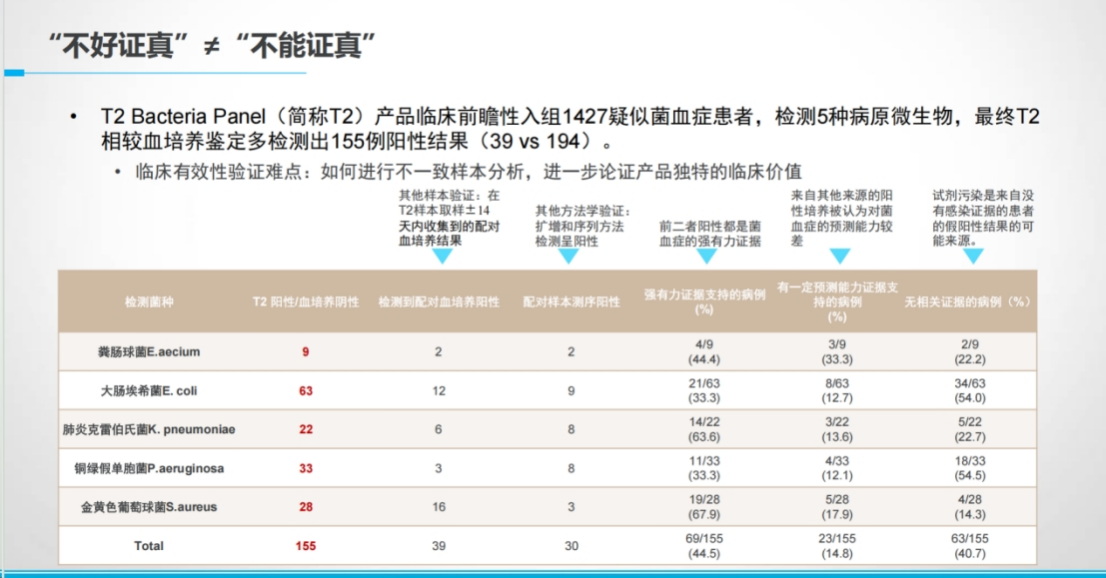
▶ 案例2:优效性设计-以临床需求为导向
肿瘤“液体活检”需要高敏感的检测方法,而数字PCR技术正好契合这一需求。
通过引入临床参考方法,设计优效性临床试验,证明申报产品的检测性能优于已上市产品。

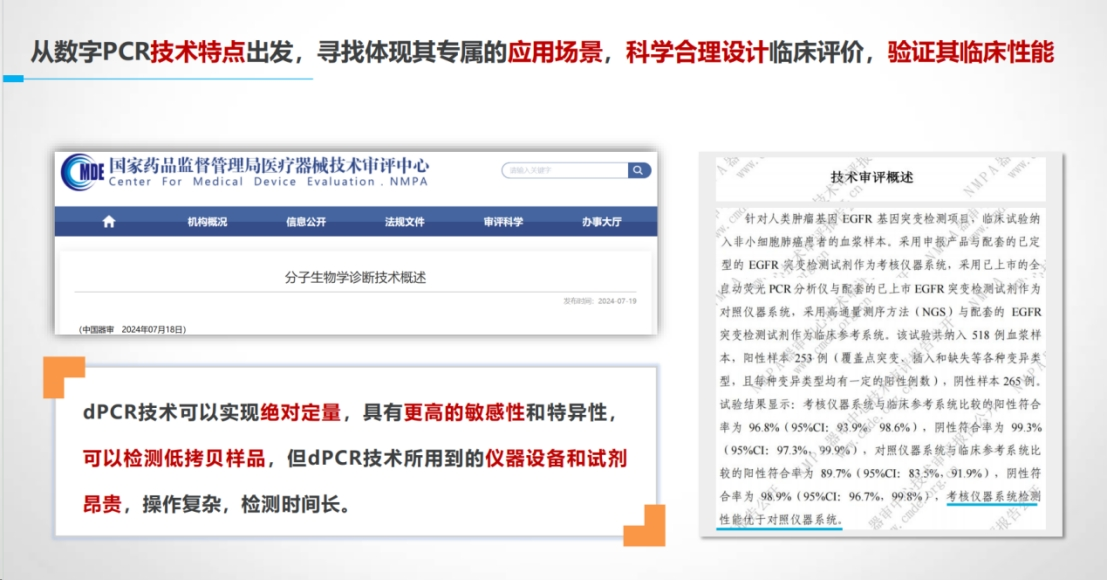
▶反例:新方法并非越灵敏越好
灵敏度提升并非在所有场景都具有正向临床价值。
以HPV筛查为例,过高的检测灵敏度可能导致阳性预测值降低,反而削弱产品的临床应用优势。
技术优化应当以解决特定临床问题为导向,而非盲目追求灵敏度指标。

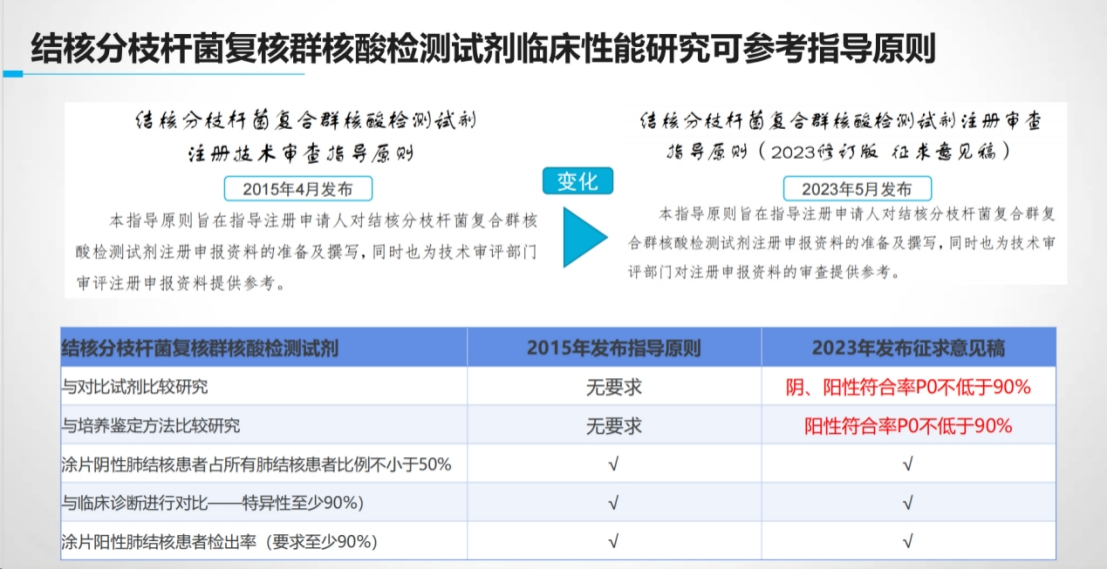
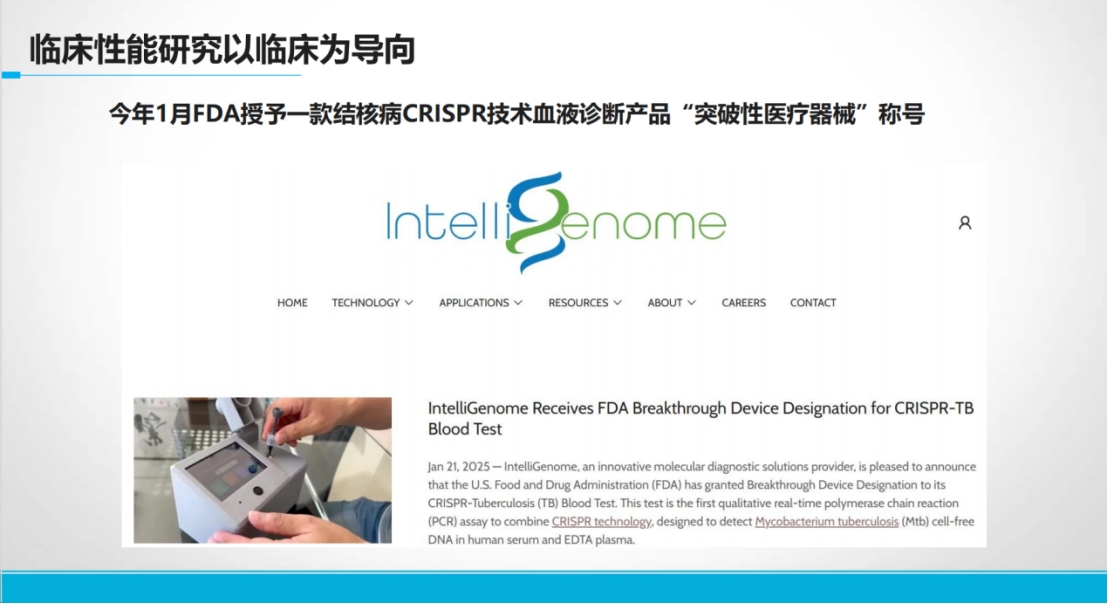
基于CRISPR技术开发尚无同类产品的创新产品,临床性能研究面临什么挑战?
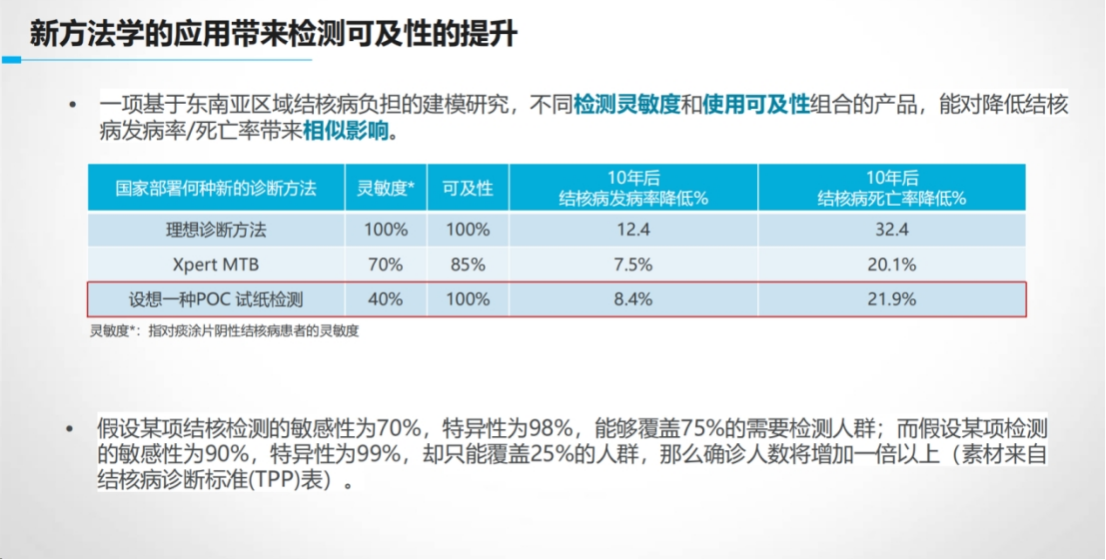
传统结核诊断依赖痰液样本和复杂设备,在特殊人群如儿童、HIV感染者及偏远地区面临巨大瓶颈。
CRISPR技术凭借设备低依赖性和常温反应特性,为破解这一难题提供新路径。
在资源有限地区,模型推演结果显示:“可及性” 比单纯追求灵敏度可能更具临床价值。
以更优可及性为创新点的CRISPR产品设计,临床研究中面临代表人群、对照标准、最低可接受性能均与常规检测产品不同的挑战。


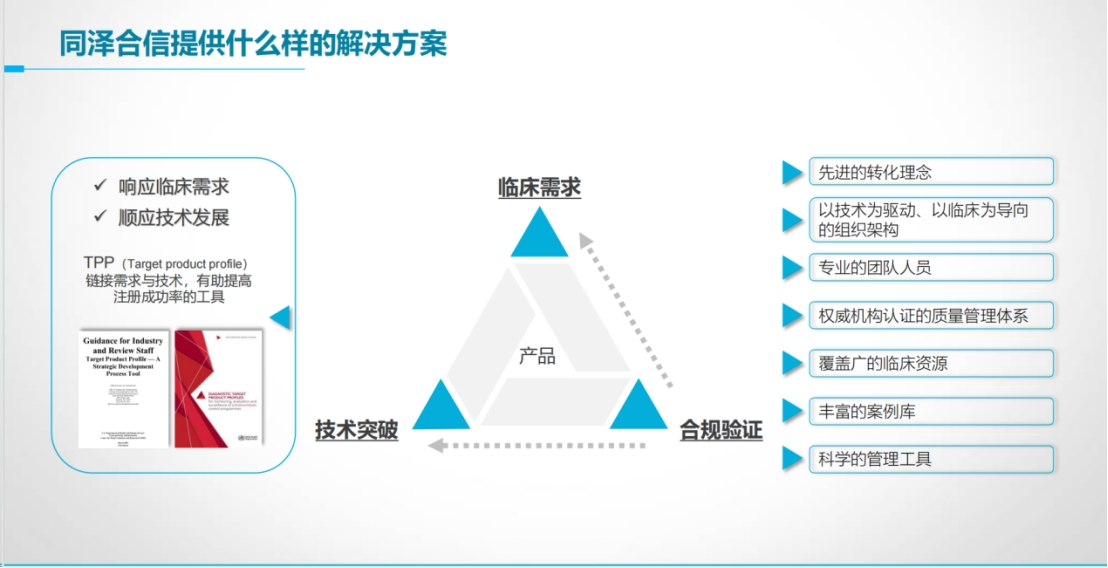
成功转化=临床需求×技术突破×合规验证。
CRISPR正以“需求导向”思维重塑诊断生态,而跨越三重关卡的核心,始终是用科学证据构“需求-技术-验证”的闭环逻辑。
同泽合信拥有丰富的创新产品服务经验,公司坚持“响应临床需求,顺应技术发展”的转化理念,聚焦技术路径、临床定位和研究合规等关键问题,助力CRISPR等新兴创新技术以更科学、高效的方式转化落地,更好地满足临床的迫切需求。
我们期待与更多研究者合作,共同推动创新诊断技术的发展与应用。






发表评论 取消回复