首期带大家了解我国创新医疗器械政策,并就清谱科技有限公司 2-羟基戊二酸/谷氨酸检测试剂盒(原位电离质谱法)做简单介绍。


▲点击上方图片,了解更多活动详情报名参会
伴随着我国支持医疗器械创新发展政策的陆续提出与落地,我国创新医疗器械发展开始进入新阶段。为方便大家了解IVD产品新的创新方向,生物诊断平台将陆续介绍部分进入创新医疗器械特别审查程序的产品。
首期带大家了解我国创新医疗器械政策,并就清谱科技有限公司 2-羟基戊二酸/谷氨酸检测试剂盒(原位电离质谱法)做简单介绍。
为促进我国医疗器械创新发展,国务院于2024年1月3日发布《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》,并提出24条意见及两个关键目标:
到2027年,药品医疗器械监管法律法规制度更加完善,监管体系、监管机制、监管方式更好适应医药创新和产业高质量发展需求,创新药和医疗器械审评审批质量效率明显提升,全生命周期监管显著加强,质量安全水平全面提高,建成与医药创新和产业发展相适应的监管体系。
到2035年,药品医疗器械质量安全、有效、可及得到充分保障,医药产业具有更强的创新创造力和全球竞争力,基本实现监管现代化。
意见的发布为我国医疗器械的创新发展指明方向。
今年7月,国家药监局发布《优化全生命周期监管支持高端医疗器械创新发展有关举措的公告》(2025年第63号)。提出了针对高端医疗器械创新发展中优化特殊审批程序、完善分类和命名原则等十项措施。
上海、北京、浙江、天津、深圳、海南、河南、贵州、广东等地也先后发布具体政策,支持生物医药产业全链条创新发展。
例如:
上海市对进入国家和上海市创新医疗器械特别审查程序的产品,按照规定给予最高300万元支持;产品首次取得注册证并落地生产的,按照规定再给予不超过研发投入的40%,最高800万元支持。
浙江省支持企业、研究院所牵头组建创新医疗器械等领域的创新联合体,组织“项目群”攻关,对能形成标志性成果的重大科技项目,省市县联动给予累计最高3000万元补助。
国家鼓励创新政策的实施,促使更多科研院所及医疗器械企业更愿意投入医疗器械创新研发,并积极将已有创新成果转化为注册证。
这一趋势在2025年进入国家药监局创新医疗器械特别审查程序的产品数量增长上得到了充分印证。
截至2025年8月12日,2025年已有10款IVD产品进入国家药监局创新医疗器械特别审查程序,其数量已大于2023和2024年合计数量。(部分软件和器械不确定最终是否会归类到IVD产品,暂列出。)
表1 我国近2年进入NMPA创新医疗器械特别审查程序的产品
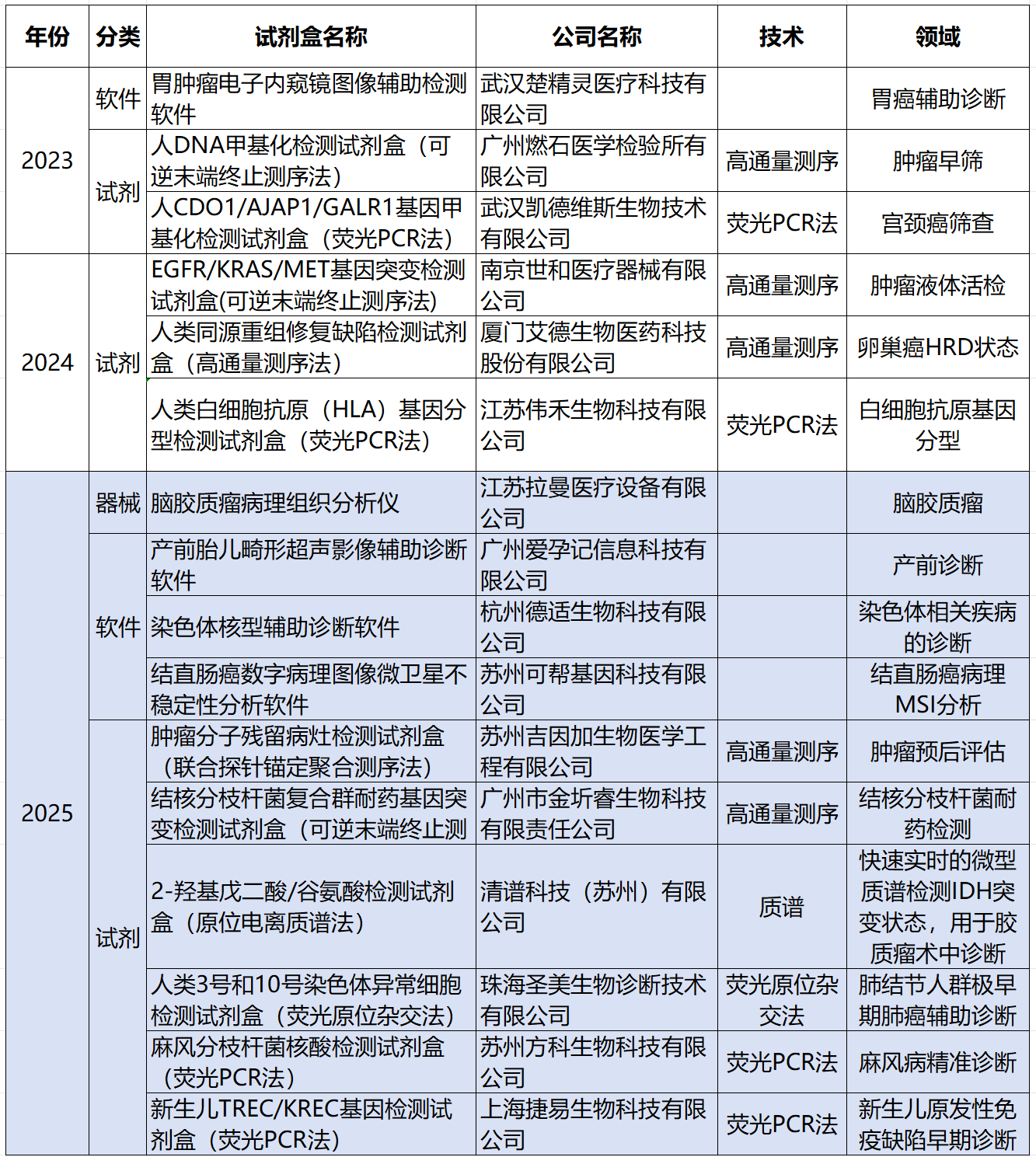
进入国家药监局创新医疗器械特别审查程序的产品意味着其产品设计上已初步具备国内首创、国际领先,且具有显著临床应用价值的基本要求。
从2025新进入审查程序的产品看,AI+病理/医学影像/辅助诊断、恶性肿瘤、结核耐药、早期诊断、预后评估、液体活检等成为关键词。
虽然这些产品尚未获得批准,但其应用领域、设计思路等也具备一定参考价值。
生物诊断平台将结合已有资料对2025年新进入审查程序的部分产品开展系列介绍。
本次来了解清谱科技有限公司2-羟基戊二酸/谷氨酸检测试剂盒(原位电离质谱法)。
背景
胶质瘤是一组具有星形细胞、少突胶质细胞及室管膜细胞表型特征的神经上皮肿瘤总称。是目前发病率最高的颅内原发恶性肿瘤,具有进展快、死亡率高且预后差的特点。
约超过80% 2-3级的胶质瘤中都存在IDH基因突变。 IDH1/2 基因突变状态检测不仅用于病理诊断、分型,还为临床预后评估及靶向治疗的研究提供帮助。
在正常细胞中,IDH (isocitrate dehydrogenase gene)基因编码的异柠檬酸脱氢酶可催化异柠檬酸转化为α-酮戊二酸和NADPH,是三羧酸循环中起关键作用的酶家族之一。
当肿瘤细胞中IDH基因发生特定位点突变时,异柠檬酸脱氢酶可依赖NADPH将α-酮戊二酸还原为痕量代谢物2-羟基戊二酸(2-HG),从而造成肿瘤细胞内2-HG的短期大量堆积。
因此可通过检测肿瘤细胞中2-HG的含量来判断IDH基因的突变状态。
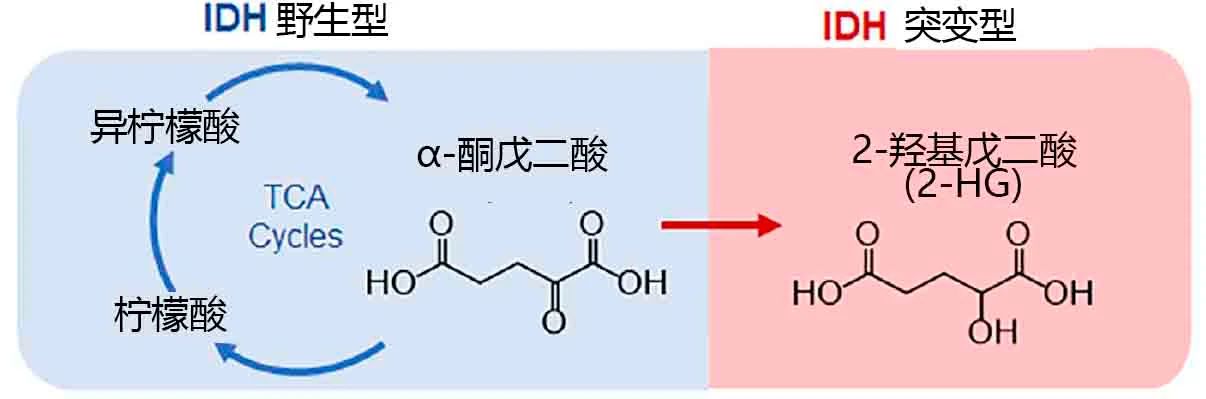
图片修改自文献[1]
谷氨酸(Glu)是大脑中含量丰富且与IDH突变无关的分子,其浓度与2-HG呈负相关,被用作串联质谱检测的内源性参照物,通过同步分析2-HG与Glu的检测信号比值来评估IDH突变状态。
核心临床应用场景与意义
核心场景:
主要用于胶质瘤术中组织活检快速检测,以实现术中识别胶质瘤的IDH突变状态。可指导划定胶质瘤手术切除范围,辅助区分胶质增生与胶质瘤。
临床意义:
神经胶质瘤具有浸润性特点,肿瘤细胞可像"树根生长"一样向周围正常的脑组织深处扩散、迁移。胶质瘤切除手术及其切除范围是影响预后的核心因素。手术中鉴别浸润与非浸润组织是手术关键。
目前仍缺乏术中IDH突变状态快速评估工具。免疫组化、PCR及高通量测序等方法广泛用于IDH突变状态检测,但难以在术中开展。MRI与CT等影像学手段可指导手术入路与切除范围,但无法直接提供分子信息。
该试剂盒结合便携式质谱仪可将IDH突变检测时间缩短至 3 分钟,可实现术中IDH突变状态检测,大大提升了诊断效率,为术中划定胶质瘤手术切除范围提供新路径。
关键产品参数
(根据公开资料整理,仅供参考)
性能:
分别在普渡大学/梅奥诊所研究、清华大学/华山医院采用不同质谱仪开展研究。
在260位胶质瘤病人的697例样品检测中。与免疫组化和基因组学方法相比,对核心区活检样本的IDH突变型胶质瘤的判定结果一致率达到100%。80%的IDH突变型肿瘤切缘活检样本检测到IDH突变评分高于非浸润组织。
检测时间:~2-3 min
检测设备:Cell微型质谱分析系统
体积:35 × 25 × 15cm
重量:≤10 kg
灵敏度:优于0.2ng/mL
供电系统:支持集成式电池供电和外部电源供电
检测过程:术中取样→快速涂片→装载取样器→质谱分析→报告生成

图片来源:清谱科技有限公司官网
可参考创新点总结
1、通过测定代谢物含量来确定突变状态的检测思路。
该检测通过测定代谢物含量,根据代谢物生成途径反推基因突变状态,为具备类似途径的肿瘤突变检测提供了新思路。
与分子检测相比,代谢物检测的成本相对更低,也更可能加快检测速度。通过代谢物检测来间接反映基因的突变状态,这可能是床旁检测及术中快速检测的新思路。
2、胜在检测速度与便携性。
保证性能的同时,3min 的检测速度使其可适配胶质瘤术中诊断场景。便携的检测仪器使其可方便的在各类手术室中快速开展。
长期以来,受产品检测速度的影响,术中快速诊断主要依赖影像学等实时诊断设备。随着体外诊断检测设备检测速度的不断缩短与便携性的提高,IVD产品将可能开辟术中快速诊断的新场景。
参考文献:
[1] Hua W, Zhang W, Brown H, Wu J, Fang X, Shahi M, Chen R, Zhang H, Jiao B, Wang N, Xu H, Fu M, Wang X, Zhang J, Zhang X, Wang Q, Zhu W, Ye D, Garcia DM, Chaichana K, Cooks RG, Ouyang Z, Mao Y, Quinones-Hinojosa A. Rapid detection of IDH mutations in gliomas by intraoperative mass spectrometry. Proc Natl Acad Sci U S A. 2024 Jun 4;121(23):e2318843121.
[2] 中华医学会病理学分会脑神经病理学组 胶质瘤分子病理诊断中国专家共识(2025版)






发表评论 取消回复