结合非痰液样本已开展的临床试验数据,探讨口腔拭子、血液及粪便样本用于结核诊断的现状及趋势。


笔者既往曾系统盘点过国内结核分枝杆菌检测相关产品。从WHO 2025 结核诊断指南,分析国内结核检测产品现状 270万病例未被及时发现!结核筛查有哪些新方向?
尽管国内尚无非痰液样本的结核快速筛查分子产品获批,但该领域已逐渐成为结核筛查领域新的竞争方向。本次结合非痰液样本已开展的临床试验数据,探讨口腔拭子、血液及粪便样本用于结核诊断的现状及趋势。
1、提升特殊人群结核检出率
首先,开发非痰液样本结核分子检测的意义在于提高儿童、HIV患者、肺外结核患者及其他“少痰”或“无痰”人群中结核检出率。
2023年,儿童结核约占全球结核病发病病例的12%,约130万儿童结核病例,死亡19.1万例。HIV感染者同样是结核病的高发人群,2023年HIV感染者结核病死亡16.1万人,占结核病总死亡人数的12.9%。[1, 2]
这两类人群一般难以采集足够菌量的痰液,需要通过诱导痰或胃液抽吸等手段采集诊断样本。此类操作在资源匮乏环境中可行性较低。因需要特定设备、维护和培训支持,且更依赖操作者经验,导致诊断检出率偏低。
其他人群,如部分年老体弱、意识障碍或病情严重的患者也面临无法有效咳痰的困境。而肺外结核人群可能没有肺部症状,检测痰液一般意义较小。
因此,开发非痰液样本的便捷分子检测,利于提高这些特殊人群的结核分枝杆菌检出率,降低死亡人数。
2、提高诊断的及时性和便利性,更适用于大规模社区筛查和主动发现
以痰液为目标样本开展大规模人群筛查的便捷度仍不足。
非痰液样本如拭子、血液搭配便携化检测设备可进一步提高检测的可及性,利于结核分枝杆菌的大规模人群筛查。
1、临床试验中非痰液样本的样本类型分布特点
目前,全球获批的非痰液样本便捷分子检测产品仍有限,此处以开展的临床试验对非痰液分子检测的现状做估计。
检索ClinicalTrials, WHO ICTRP及中国临床试验注册中心,获取2020年至今开展的肺结核非痰液样本分子诊断临床试验。排除开展样本类型为单一痰液、胃液、肺泡灌洗液及胸水等有创样本类型,排除研究目的为多重耐药检测及非诊断核心目的的研究,排除已撤回的研究。剩余临床诊断试验作为本次分析观察的主要数据。
近5年,3个数据库中约有32项非痰液样本结核分子诊断临床试验开展,并整体呈现逐年增加趋势,2025年开展的临床试验数量达到顶峰。(附录一、图1)
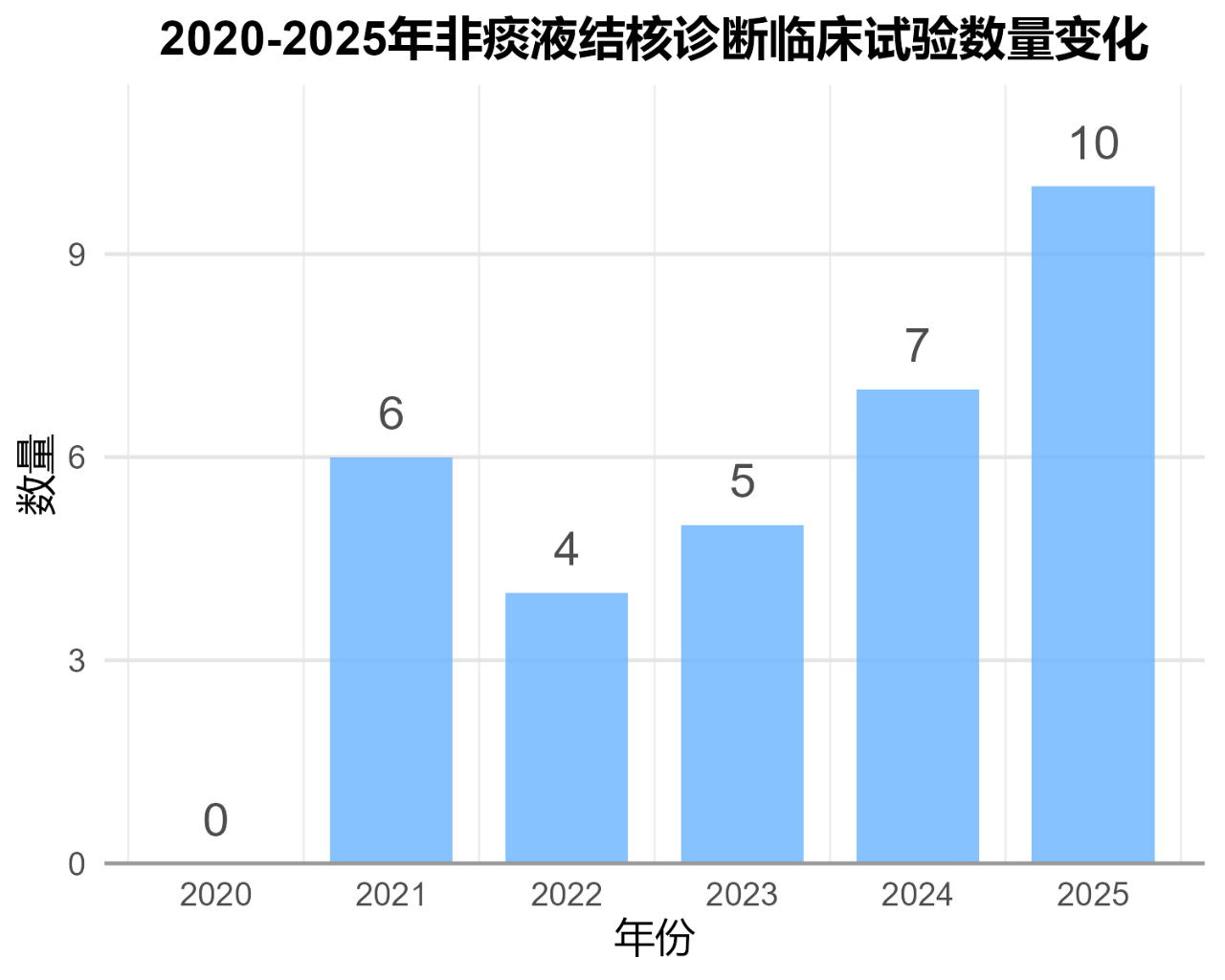
样本类型上看,涉及非痰液样本包括:拭子(包括舌拭子、口腔拭子、鼻咽拭子)、血液、粪便、深喉唾液等。相关临床试验数量见图2及附录一。
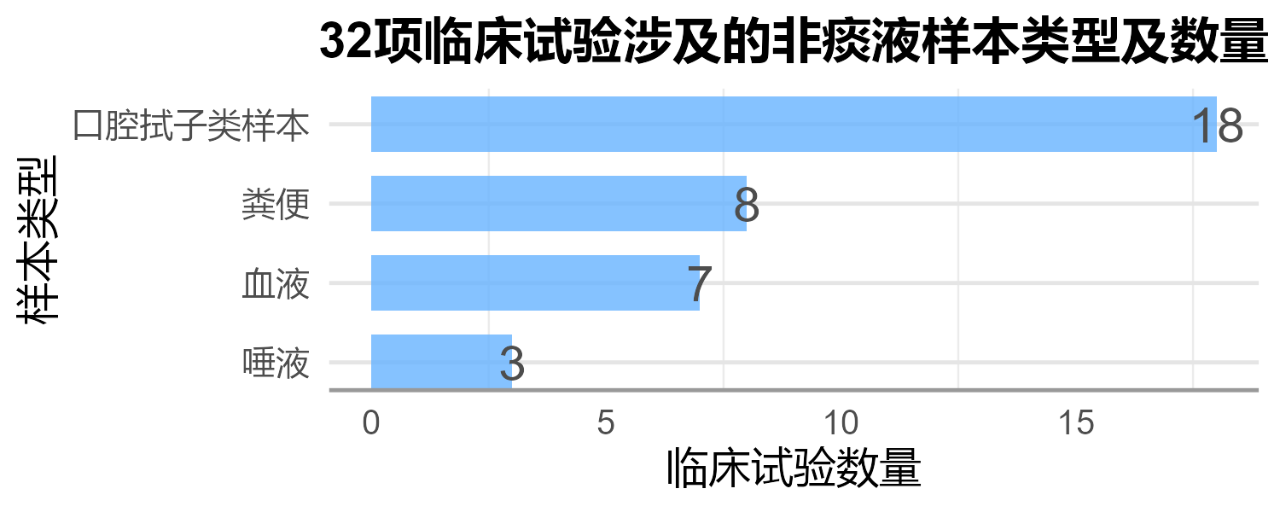
32项临床试验中,国内有10项。主要涉及样本包括:口腔拭子(7项)、深喉唾液(2项)、血液(1项)。(附录一)
因此,从以上数据看,以舌拭子为主的口腔拭子样本是近年来结核分枝杆菌诊断试剂转化的核心方向。此外,与国外8项基于粪便的结核分枝杆菌诊断方法相比,国内近年尚未见有相关临床试验开展。
2、各类样本类型的检测与应用特点
口腔拭子
为提升结核病检测可及性,口腔类拭子已被提议作为肺结核诊断的新型临床样本。国内也已有多家公司宣称其以PCR为检测原理的产品可用于舌拭子样本检测。但国内尚无基于舌拭子的结核分子检测产品获批。WHO至今尚未就基于口腔拭子的结核病检测提出官方建议。
2023年发表的系统综述中评估了16篇以口腔拭子/舌拭子的临床研究,成人组口腔拭子检测敏感性区间为36%(95%置信区间26-48)至91%(80-98),儿童组为5%(1-14)至42%(23-63)。所有研究的特异性区间为66%(52-78)至100%(97-100),其中大多数研究报告的特异性超过90%。[3]
2024年的一篇系统综述的结果与上述结果呈现出一定差别,其分析显示口腔拭子检测对肺结核患者的合并敏感性为0.67,特异性为0.95。[4]
因此,采用口腔类拭子进行结核分枝杆菌检测,不同检测方法间的检测性能差别仍较大,并呈现低灵敏度、高特异度的特点。
儿童患者是其着重需覆盖的一类目标人群,但目前研究显示其在儿童患者中的检测灵敏度相对低,并且不同研究间的差异较大。因此,该检测灵敏度是否能够达到WHO的性能要求仍有待确认。
近年来,为提高口腔拭子检测的灵敏度,CRISPR检测方法被逐步用于口腔拭子检测,例如,今年我国已有两项采用CRISPR诊断方法进行口腔拭子检测的临床试验登记。(附录一)
总之,从研究数量看,口腔拭子是目前非痰液结核分子检测研究最多的样本类型,参考企业年报等公开信息,国内公司,如予果生物、兰卫医学、迪安诊断等已有相关RUO试剂盒。该样本类型仍是未来5年国内最有转化潜力的非痰液检测产品。
粪便
2020年,世界卫生组织将粪便样本纳入分子诊断指南,推荐其用于结核病细菌学确认。
2025年7月发表的1篇综述显示,以16岁以下疑似结核病儿童为研究对象。
以呼吸道样本的任何细菌学确认结果作为参考标准时,粪便Xpert的敏感度为0.60(95% CI 0.48–0.71),粪便Xpert Ultra为0.73(0.63–0.81),其他内部分子检测方法合并敏感度为0.44(0.29–0.60)。[1]
以结核病病例定义为参考标准时,粪便Xpert敏感度为0.23(0.11–0.41),粪便Xpert Ultra为0.38(0.22–0.56),其他内部分子检测方法为0.17(0.09–0.23)。[1]
粪便Xpert Ultra检测使结核病细菌学确诊率总体提升38.6%。[1]
不过,随着粪便检测的广泛推广,一些实操难题逐渐显现。粪便虽易于获取但并非能按需产生,因此样本常需在家采集并保存后送检。可能存在样本污染风险及诊断样本丢失的潜在问题等。并且,粪便样本前处理仍主要依赖涡旋或离心等多步骤的设备,一定程度降低了其可及性。
国内尚未见以粪便为检测样本的获批产品。近年也未见国内开展相关临床试验。
血液
采用血液进行结核分枝杆菌检测目前主要有两种策略。
①基于DNA的检测策略
血液样本可显著增加结核筛查的可及性,并可解决无痰患者、肺外患者及儿童患者的结核分枝杆菌筛查要求。
已有研究采用数字PCR技术进行血液外周血单核细胞中的结核分枝杆菌基因组DNA检测,整体检出率达79%。但该策略难以用于大规模人群筛查,可及性仍有限。[5]
国外Intelligenome公司联合杜兰大学开发的CRISPR-TB产品于今年获FDA突破性医疗器械称号。
杜兰大学的研究显示,CRISPR-TB产品对确诊结核病例的检测灵敏度达96%,特异性达94%;在儿童队列中灵敏度为83%,特异性为95%,且成功检出全部6例肺外结核病例。[6]
不过,从技术角度看,结核分枝杆菌本身难破壁,其cfDNA入血量极低并呈现碎片化,运用扩增+CRISPR的检测方式存在一定的技术瓶颈。
尽管杜兰大学相关研究的检测性能较好,但该研究的样本量仍有限(成人队列45人,儿童队列28例),需要进一步临床试验验证其在人群中大规模应用的实际检测效果。
若该技术可完成临床转化,从可及性、便利性等方面将占据优势,且可有效解决儿童、HIV患者、其他少痰人群及肺外结核患者的结核分枝杆菌检测问题,将占据一定技术优势。
国内尚未见采用相似技术路线的临床试验及科研文献。
②基于RNA的检测策略
已有多个国内外研究通过转录组测序得到多个cfRNA或小RNA等标志物,之后组合检测用于结核与非结核患者的诊断。但该策略仍依赖测序方法,其临床转化潜力仍有待评估。
在32项临床试验中,近两年中,有4项临床试验采用CRISPR为基础的检测方法,分别用于口腔拭子(2项)及血液cfDNA检测(2项)。
无论是采用口腔拭子或血液样本进行结核分子检测,目前存在的问题主要在于其灵敏度相对有限或检测便携度不足。
CRISPR诊断技术结合扩增方法可显著提高样本检测的灵敏度,是非痰液样本分子检测的重要技术方向。
总之,非痰液样本结核便捷分子检测已成为结核筛查中的重要竞争方向,用于解决儿童患者、HIV患者、少痰人群以及肺外结核的筛查与诊断困境。
口腔拭子、粪便及血液样本是当前主要关注的样本类型。其中口腔拭子检测的研究最多,但尚未获WHO推荐;粪便检测已获WHO推荐,但也面临灵敏度低、检测样本可及性仍不足等问题;基于cfDNA的血液样本的便捷检测有较大的应用潜力,但可能有一定技术瓶颈,尚需更多的临床试验验证。
国内关注的检测样本类型以口腔拭子类样本为主,将会成为结核筛查中新的竞争方向。但国内基于粪便及血液样本的便捷分子诊断试验仍不足,将可能是未来国内结核筛查中的新路径。
扩增+CRISPR诊断技术已逐步成为非痰液样本检测中的新兴策略,可用于拭子、血液等低病原样本检测。
参考文献
[1]Carratalà-Castro L et al. Performance of stool-based molecular tests and processing methods for paediatric tuberculosis diagnosis: a systematic review and meta-analysis. Lancet Microbe. 2025 Jun;6(6):100963.
[2] WHO, Global tuberculosis report 2024.
[3] Church EC, Steingart KR, Cangelosi GA, Ruhwald M, Kohli M, Shapiro AE. Oral swabs with a rapid molecular diagnostic test for pulmonary tuberculosis in adults and children: a systematic review. Lancet Glob Health. 2024 Jan;12(1):e45-e54.
[4] Zhang F, Wang Y, Zhang X, Liu K, Shang Y, Wang W, Liu Y, Li L, Pang Y. Diagnostic accuracy of oral swab for detection of pulmonary tuberculosis: a systematic review and meta-analysis. Front Med (Lausanne). 2024 Mar 11;10:1278716.
[5] Martineau AR, Chandran S, Palukani W, Garrido P, Mayito J, Reece ST, Tiwari D. Toward a molecular microbial blood test for tuberculosis infection. Int J Infect Dis. 2024 Apr;141S:106988.
[6] Huang Z et al. CRISPR detection of circulating cell-free Mycobacterium tuberculosis DNA in adults and children, including children with HIV: a molecular diagnostics study. Lancet Microbe. 2022 Jul;3(7):e482-e492.
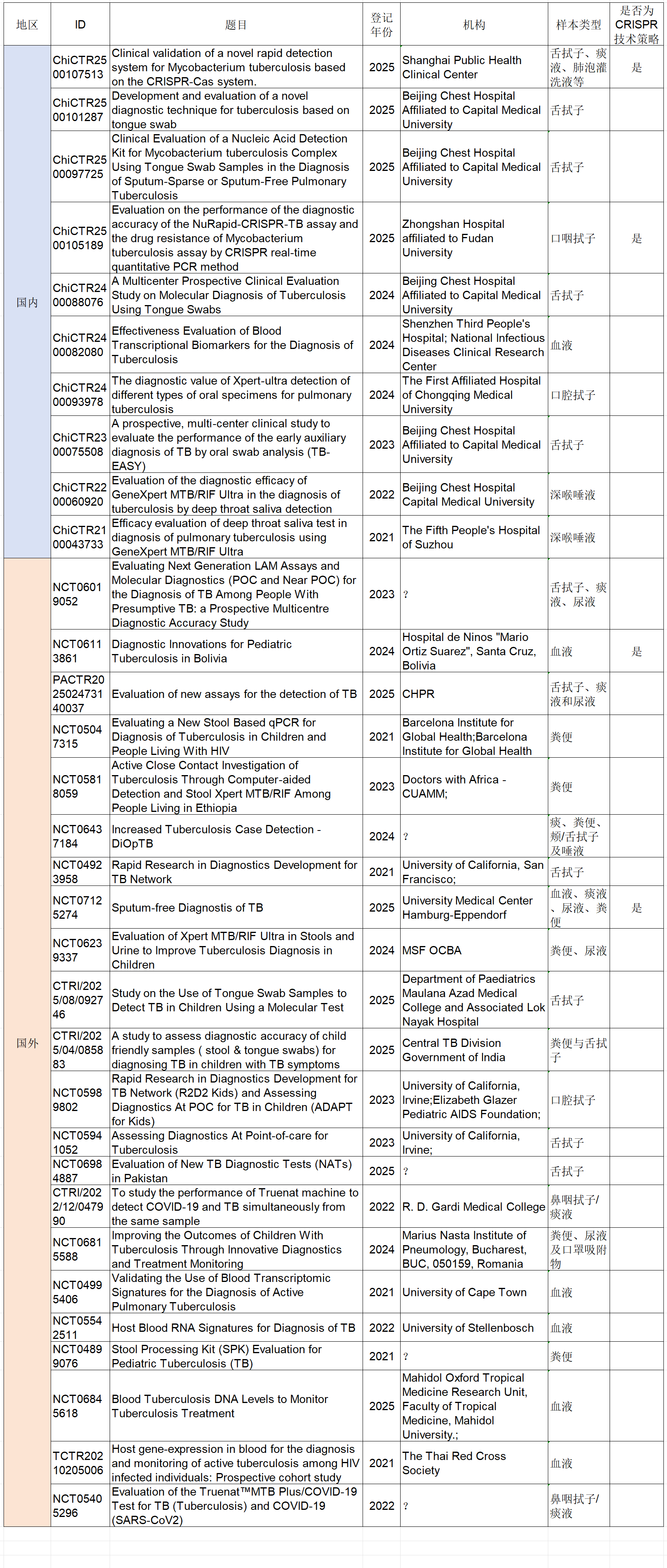
附录一 32项非痰液样本结核分子诊断临床试验信息



发表评论 取消回复