随着甲基化等检测技术的发展, 一管血多癌种早期检测(multi-cancer early detection, MCED)成为现实,将可能重塑传统的恶性肿瘤筛查模式。


上期,我们系统分析了国内单癌种甲基化检测产品,参见:国内单癌种甲基化检测产品特点与趋势分析。
随着甲基化等检测技术的发展, 一管血多癌种早期检测(multi-cancer early detection, MCED)成为现实,将可能重塑传统的恶性肿瘤筛查模式。多癌早筛产品有哪些优势?目前的发展中还存在哪些现实挑战?
01
多癌种早期检测(multi-cancer early detection, MCED)可通过单一易获取的生物样本(如血液)同时筛查多种癌症。[2]
附表汇总了部分国内外公司及研究中MCED采用的技术路线,整体看,基于cfDNA的甲基化检测技术应用最广泛(至少有7款产品),其次包括cfDNA片段组学检测技术、甲基化 + 片段组学技术、代谢组、突变检测、蛋白质检测、循环肿瘤细胞检测等多种技术方向。
技术平台上,因多癌种筛查往往需要覆盖较多的甲基化位点,对于基因检测,实际应用中NGS为主流技术平台,此外,也有基于qPCR, 数字PCR的少甲基化位点检测及基于质谱检测平台的代谢物及蛋白质检测等。
从检测癌种看,Grail公司Galleri产品最多支持检测50多个癌种。此外,已至少有3款针对消化道肿瘤的检测产品。(详见附录)
02
与单癌种甲基化检测兼具筛查及辅助诊断的功能不同,MCED检测产品的核心功能更加聚焦,即应用于肿瘤筛查,理论上不适于辅助诊断场景。
这一核心定位即决定了MCED产品的核心价值追求在于:旨在更早地,在可治疗的阶段检测出癌症,从而降低癌症死亡率。
与传统筛查方法相比,MCED的核心优势在于:
1、提高筛查效率
MCED可采用单一样本同时检测多种癌症,尤其可纳入目前尚无筛查手段的高致死率癌种。与基于单癌种的多次筛查相比,大大降低了重复筛查人数。
加之血液样本检测便利性高,可进一步提高筛查效率。
同时,未来若MCED可取代部分传统筛查方法,则可进一步简化筛查流程、降低总的筛查成本。
2、检测特异性高
为减少假阳性导致的过度检查,多数MCED设计为高特异性检测。
既往综述中汇总了16篇MCED相关研究发现,MCED研究的检测特异度范围在84%-99.7%之间。16项研究中有9项研究的特异性达到或接近99%,其中基于cfDNA甲基化的检测技术普遍呈现出结果的高特异性。[1]
这种高特异性的产品设计思路可大大降低假阳性率,提升检测的阳性预测值(PPV)。
03
1、MCED的检测性能如何?
如前所述,更早地,在可治疗的阶段检测出癌症,从而降低癌症死亡率是肿瘤早期筛查的核心目的。MCED能够达成这个目的吗?
尽管各厂家宣称其多癌早筛产品具备较高的灵敏度和特异性,但若其开展研究的人群为已处于晚期或不可治愈阶段的患癌人群,检测性能将被高估,数据的参考价值将大打折扣。
同时,不同研究中对于“早期癌症”的定义范围可能从癌前病变延伸至无症状III期癌症,这种对于“早期癌症”定义的差异使不同研究及不同产品间的检测性能往往不具有可比性。[2]
目前,MCED产品大规模前瞻性研究的数量仍然有限。
从部分已有前瞻性研究的结果看,MCED检测的PPV在19.4%-39.53%之间,灵敏度在27.1%-70.83%之间(表1)。从现有数据看,MCED PPV高于传统筛查方法,如乳腺癌钼靶检查PPV约为6%–7%、宫颈癌CIN3+的HPV筛查PPV约为7.2%、肺癌低剂量计算机断层扫描(LDCT)筛查PPV约为4%。[1]
表1 部分已有MCED前瞻性研究的性能特点
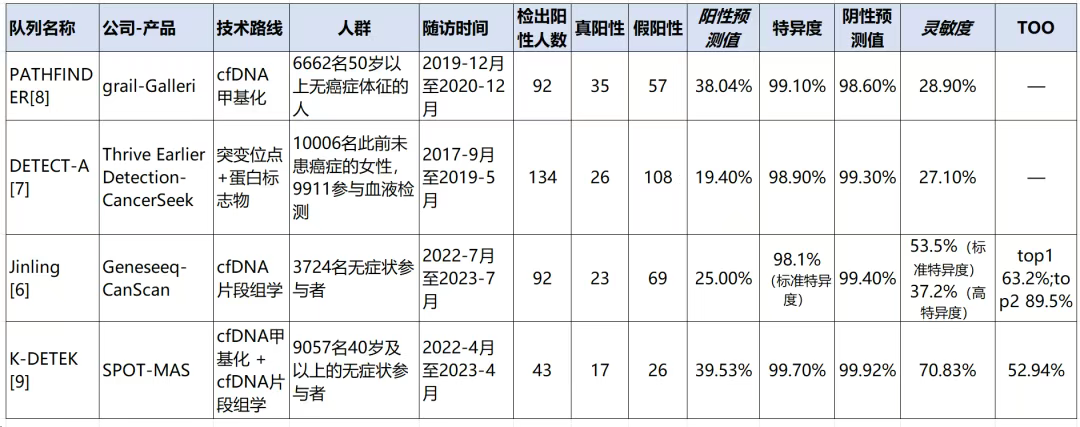
注:TOO(tissue of origin )指肿瘤的组织溯源预测准确率。
不过,这些MCED研究的样本量仍然有限,且随访时间均在1年左右,均非评价MCED对癌症死亡率的影响,可能仅能初步反映MCED检测在早筛中的应用价值。
并且,目前尚未见前瞻性筛查无症状人群的随机对照试验(RCT)结果,缺少最高等级证据支撑。对于 MCED 在前瞻性筛查队列中的性能要求尚无明确的标准。
参考已有综述[1],已至少有17项前瞻性研究正在开展中,其中包括1项RCT研究。
随着各大研究结果的发表,将会为MCED产品的前瞻性筛查性能标准制定提供更多依据,从而真正明确MCED在癌症筛查中的定位和价值,为后续大规模人群筛查开展提供基础。
2、MCED能否降低总的筛查成本与人数?
除可检测目前尚无筛查手段的癌种外,MCED还可同时对已有筛查方式的癌症开展筛查,如乳腺癌、宫颈癌、结直肠癌和肺癌等。
随着单癌种甲基化检测日益成熟,MCED未来是否能够真正重构整个筛查体系,还取决于其是否能够借助自身产品特点,达到降低总体筛查人数,进而降低整体筛查成本、提升筛查效率的目的。
想要达到这一目的,不仅要依赖优异的产品检测性能,也对产品检测成本提出更高的要求。在真正具备高性价比的情况下,才更可能实现逐步替代原有筛查方案,真正重构整个肿瘤筛查模式。
3、如何构建完整的筛查与诊疗闭环?
除了以上挑战外,由于MCED可同时检测多个癌种,从筛查前到筛查后的闭环服务构建将比传统的筛查手段更加复杂。
假阳性问题
尽管MCED具备较高的特异度,但由于大部分肿瘤的发病率较低(0.37/10万- 40.78/10万不等)[10],未患病人数会远远大于患病人数,一旦开始大规模筛查工作,长期累积的假阳性人数仍会很多。以检测特异度为99%为例,10万人一年可至少产生1000例假阳性。
对于这些假阳性人群,除了要面对精神焦虑外,后续确诊将难免经历侵入性检查。同时,目前MCED组织溯源准确性仍有待进一步提升,为了确诊,患者可能面临多个器官同时进行侵入性检查的风险。
除了通过不断提升产品性能来尽可能避免假阳性外,检测阳性时,构建配套的标准分级诊断体系可能更重要,一方面尽可能减少后续诊断支出,另一方面引导患者基于当前诊断结果选择更加合理诊疗路径,尽量避免更多的有创检查。
在此基础上,当假阳性发生时,才能尽可能降低检测者的不满意度,提高整体产品检测体验。
假阴性问题
作为筛查工具,MCED检测仅评估患癌概率而非确诊癌症,相比之下,MCED检测灵敏度相对低,假阴性结果不可避免。
但消费者往往不会去了解其中原理,并且,MCED产品实际售价相对高(一般在千元左右或以上),一旦多次产生假阴性将大大降低用户对于检测的信任度,不利于MCED的大范围推广。
因此,一方面应当让消费者清晰了解到产品的实际检测能力与适用场景,并结合其他筛查手段尽可能降低筛查的假阴性;
另一方面,与保险公司等机构建立密切合作,在假阴性发生时给予配套的赔付,构建假阴性结果处理闭环也可进一步增加患者对于产品的信任度。
4、警惕过度诊断
先来看一个肿瘤早筛过度诊断的典型案例。
1999年,韩国启动了针对癌症及其他常见病的国家筛查计划。作为附加项目,许多医院推广包含甲状腺癌超声筛查的"健康体检"项目。这一项目开启后,甲状腺癌发病率在20世纪90年代缓慢上升,在新世纪后迅速增长,2011年的诊断率是1993年的15倍,但甲状腺癌死亡率保持稳定。早期筛查并未降低甲状腺癌死亡率。
同时,甲状腺癌手术后,多数人需终身接受甲状腺替代治疗,部分患者会出现手术并发症,大大降低了患者的生活质量。[5]
部分肿瘤生长缓慢、可能终生不会引发疾病或死亡,针对此类疾病的过度诊疗可能给患者生活和生理带来不可挽回的损伤,最终对患者有害而无益。
尽管从原理上看,癌症患者的cfDNA水平高于健康个体,转移性癌症患者体内的cfDNA片段浓度高于局限性癌症患者。ctDNA可能具备识别侵袭性、能从治疗中获益肿瘤的能力[4]。但在尚无明确研究结论之前,MCED仍需警惕过度诊断。
另外,应当看到,MCED的研发与推广,仍需依赖肿瘤诊疗路径整体成熟度的提升。一方面,对于尚缺乏早期成熟治疗方案的肿瘤,即使成功检测,最终可能也无法降低患者的死亡风险。另一方面,即使MCED筛查为真阳性,但后续检测手段难以最终确诊,或确诊时间较长,也可能让实际筛查收益大打折扣。
最后,无论是分级诊疗体系的建立,还是强化基层医疗的政策倾斜,国家整体政策都是向着促进医疗资源公平分配的方向推进。作为筛查工具,未来,MCED不应只局限在部分核心城市大医院或中高端体检中心,理应走入基层,让先进检测技术惠及更多人。而这,需要检测公司、科研机构、医院、政府机构等共同努力,仍然任重道远。
04
总之,与传统筛查方式相比,MCED 可采用单一样本同时筛查多种癌症,尤其可纳入目前尚无筛查手段的高致死率癌种,有望大大提高筛查效率,同时具备高特异度的优势。
更早地,在可治疗的阶段检测出癌症,从而降低癌症死亡率是MCED要实现的核心价值。应当看到,MCED产品大规模前瞻性研究结果的数量仍然有限,可能仅能初步反映MCED在肿瘤早筛中的应用价值,已有多项前瞻性研究正在开展中。
除了检测性能仍需进一步确认外,实际应用过程中,面对可能的假阳性及假阴性,需要联合检测公司、保险公司、科研机构、医院及政府等部门共同构建筛查前、筛查过程中及筛查后的完整筛查、诊疗与服务模式,并警惕过度诊断的可能。
随着前瞻性研究结果的不断丰富、政策的推动以及其他诊疗方法的不断成熟,MCED将会在肿瘤筛查路径中找到自己的特定位置,并可能重塑传统的恶性肿瘤筛查模式,真正实现通过高效筛查降低肿瘤死亡率的目标。
附录
部分多癌早筛检测产品或研究信息
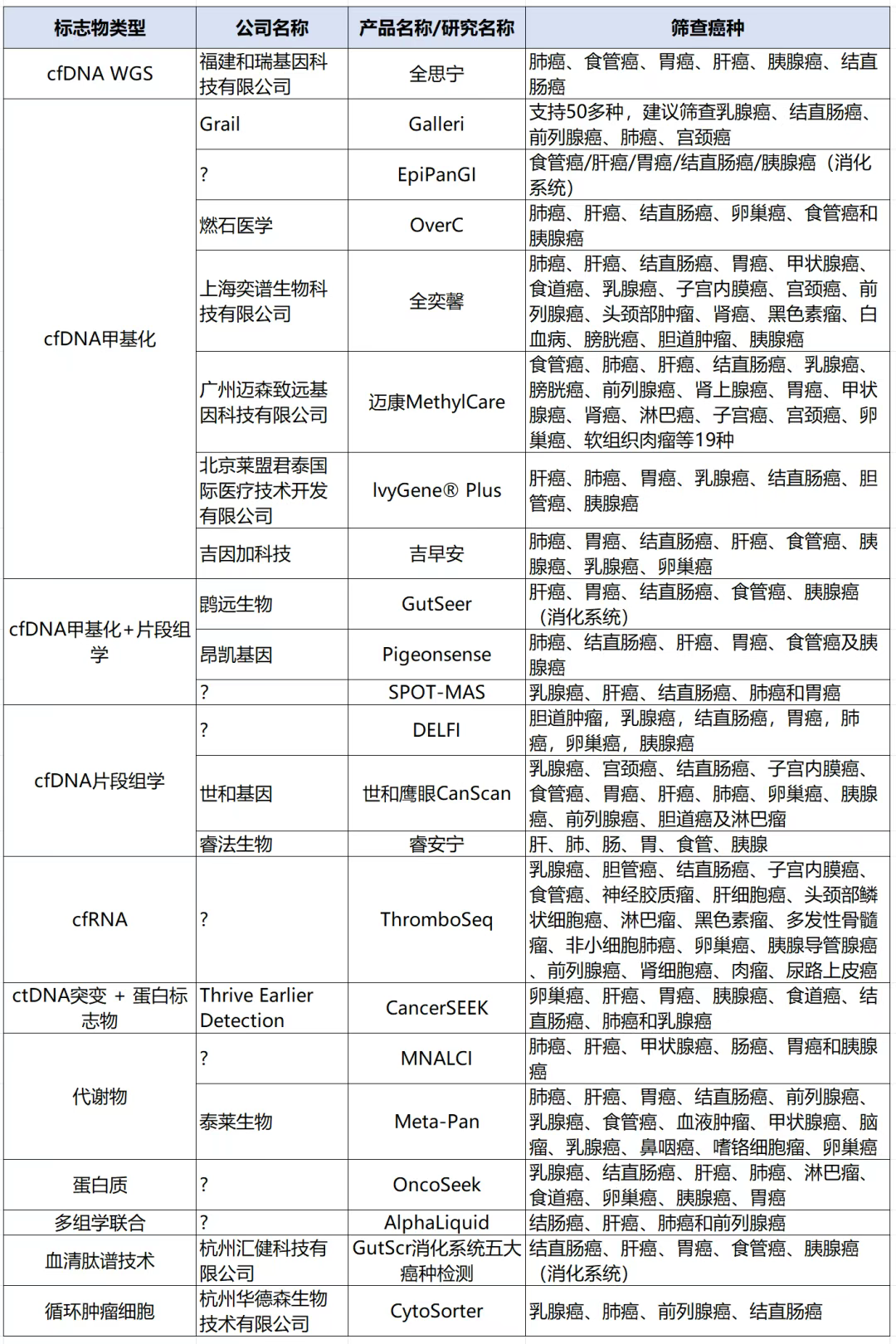
注:信息来源于网络公开信息及文献[11], 仅供参考
参考文献
[1]Xu Y, Zhu S, Xia C, Yu H, Shi S, Chen K, He Y, Deng C, Jin H, Liu J, Fitzgerald R, Basu P, Chen W. Liquid biopsy-based multi-cancer early detection: an exploration road from evidence to implementation. Sci Bull (Beijing). 2025 Sep 15;70(17):2852-2867.
[2]Rubinstein WS, Patriotis C, Dickherber A, Han PKJ, Katki HA, LeeVan E, Pinsky PF, Prorok PC, Skarlupka AL, Temkin SM, Castle PE, Minasian LM. Cancer screening with multicancer detection tests: A translational science review. CA Cancer J Clin. 2024 Jul-Aug;74(4):368-382.
[3]Kang SK, Gulati R, Moise N, Hur C, Elkin EB. Multi-Cancer Early Detection Tests: State of the Art and Implications for Radiologists. Radiology. 2025 Jan;314(1):e233448.
[4]Pessoa LS, Heringer M, Ferrer VP. ctDNA as a cancer biomarker: A broad overview. Crit Rev Oncol Hematol. 2020 Nov;155:103109.
[5]Ahn HS, Kim HJ, Welch HG. Korea's thyroid-cancer "epidemic"--screening and overdiagnosis. N Engl J Med. 2014 Nov 6;371(19):1765-7.
[6]Bao H, Yang S, Chen X, Dong G, Mao Y, Wu S, Cheng X, Wu X, Tang W, Wu M, Tang S, Liang W, Wang Z, Yang L, Liu J, Wang T, Zhang B, Jiang K, Xu Q, Chen J, Huang H, Peng J, Xia X, Wu Y, Xu S, Tao J, Chong L, Zhu D, Yang R, Chang S, He P, Xu X, Zhang J, Shen Y, Jiang Y, Liu S, Zhang X, Wu X, Wang X, Shao Y. Early detection of multiple cancer types using multidimensional cell-free DNA fragmentomics. Nat Med. 2025 Aug;31(8):2737-2745.
[7]Lennon AM, Buchanan AH, Kinde I, Warren A, Honushefsky A, Cohain AT, Ledbetter DH, Sanfilippo F, Sheridan K, Rosica D, Adonizio CS, Hwang HJ, Lahouel K, Cohen JD, Douville C, Patel AA, Hagmann LN, Rolston DD, Malani N, Zhou S, Bettegowda C, Diehl DL, Urban B, Still CD, Kann L, Woods JI, Salvati ZM, Vadakara J, Leeming R, Bhattacharya P, Walter C, Parker A, Lengauer C, Klein A, Tomasetti C, Fishman EK, Hruban RH, Kinzler KW, Vogelstein B, Papadopoulos N. Feasibility of blood testing combined with PET-CT to screen for cancer and guide intervention. Science. 2020 Jul 3;369(6499):eabb9601.
[8]Schrag D, Beer TM, McDonnell CH 3rd, Nadauld L, Dilaveri CA, Reid R, Marinac CR, Chung KC, Lopatin M, Fung ET, Klein EA. Blood-based tests for multicancer early detection (PATHFINDER): a prospective cohort study. Lancet. 2023 Oct 7;402(10409):1251-1260.
[9] Nguyen LHD, Nguyen THH, Le VH, Bui VQ, Nguyen LH, Pham NH, Phan TH, Nguyen HT, Tran VS, Bui CV, Vo VK, Nguyen PTN, Dang HHP, Pham VD, Cao VT, Phan NM, Tieu BL, Nguyen GTH, Vo DH, Tran TH, Nguyen TD, Nguyen VTC, Nguyen TH, Tran VU, Le MP, Tran TMT, Nguyen Nguyen M, Van TTV, Nguyen AN, Nguyen TT, Doan NNT, Nguyen HT, Doan PL, Huynh LAK, Nguyen TA, Nguyen HTP, Lu YT, Cao CTT, Nguyen VT, Le Quyen Le T, Luong TL, Doan TKP, Dao TT, Phan CD, Nguyen TX, Pham NT, Nguyen BT, Pham TTT, Le HL, Truong CT, Jasmine TX, Le MC, Phan VB, Truong QB, Tran THL, Huynh MT, Tran TQ, Nguyen ST, Tran V, Tran VK, Nguyen Nguyen H, Nguyen DS, Van Phan T, Do TT, Truong DK, Tang HS, Giang H, Nguyen HN, Phan MD, Tran LS. Prospective validation study: a non-invasive circulating tumor DNA-based assay for simultaneous early detection of multiple cancers in asymptomatic adults. BMC Med. 2025 Feb 14;23(1):90.
[10]Han B, Zheng R, Zeng H, Wang S, Sun K, Chen R, Li L, Wei W, He J. Cancer incidence and mortality in China, 2022. J Natl Cancer Cent. 2024 Feb 2;4(1):47-53.
[11]陈万青等,基于液体活检技术的多癌种联合筛查专家共识制定工作组,基于液体活检技术的多癌种联合筛查专家共识(2025版)




发表评论 取消回复