国内已获批的单癌种甲基化检测产品特点及发展趋势


甲基化检测已成为肿瘤分子早筛方法中的核心技术路线,逐步应用于单癌种早筛和泛癌早筛中。
本期我们以甲基化基本概念入手,从检测靶标、检测性能及技术路线等方面详细分析国内已获批的单癌种甲基化检测产品特点及发展趋势。
01
每个个体都拥有独特的基因组,如果说基因组是个体的生命信息手册,那么,对于包括人类在内的哺乳动物中,这份生命信息手册由两个层面构成:
一是,DNA文本本身;
二是,指导细胞如何解读该文本的化学修饰系统,即甲基化。
虽然人体所有细胞类型都携带相同的DNA序列,但其甲基化模式却各不相同。例如,许多特异性在肝脏表达的基因在肝细胞中处于非甲基化状态,而在其他所有组织中则被甲基化;优先在心脏中表达的基因仅在心肌细胞中保持非甲基化状态。[5]
从分子机制上看,DNA甲基化是一种DNA的共价修饰,具体是指DNA甲基转移酶将甲基加到DNA CpG(胞嘧啶-磷酸-鸟嘌呤)序列中胞嘧啶(C)的5'碳位,形成5-甲基胞嘧啶的过程。(图1)当启动子或增强子等基因调控序列存在DNA甲基化时,就会抑制基因表达。[3]
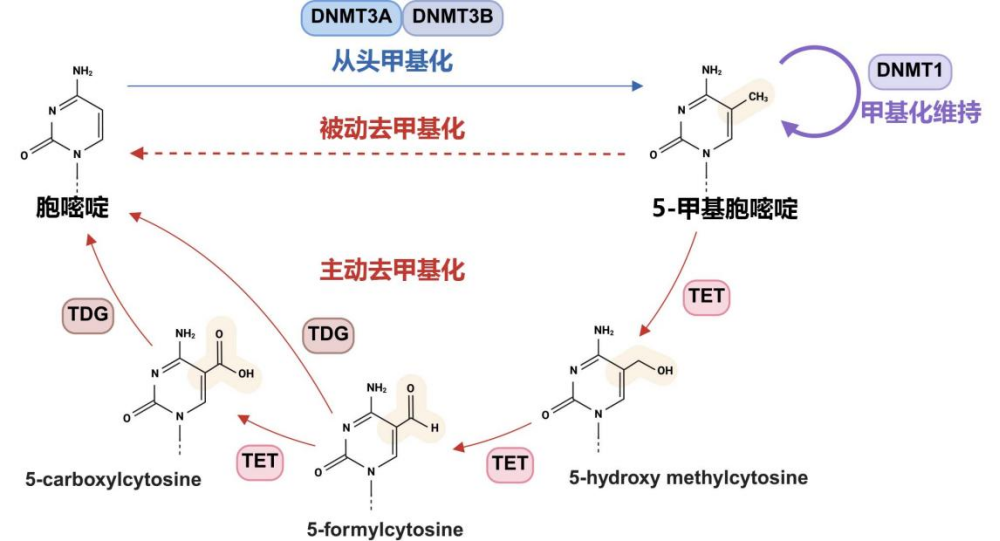
图1 DNA甲基化作用机制示意图:本图谱概括了DNA甲基化标记建立、维持与去除的核心通路——包括DNMT3A/B介导的从头甲基化、DNMT1执行的维持性甲基化,以及通过TET酶和TDG介导的碱基切除修复实现的主动去甲基化过程,揭示了表观遗传状态在基因表达调控中的动态平衡机制。整理自文献[4]
癌症具有复杂的甲基化特征。与非瘤组织相比,肿瘤组织整体呈现DNA低甲基化,但CpG岛却出现高甲基化。启动子CpG岛高甲基化与基因体低甲基化共同导致基因沉默。DNA异常甲基化改变贯穿于癌症发生和发展的全过程。[3]
一些DNA甲基化异常发生在肿瘤形成的初始阶段,通过检测与肿瘤发展相关的甲基化标志物,可以辅助癌症早期诊断、评估进展风险。除了可用于早期诊断与筛查外,甲基化标志物还可用于肿瘤的伴随诊断及预后监测等场景。
02
目前临床最常用的DNA甲基化检测平台为实时荧光定量 PCR、数字PCR、NGS及核酸质谱等,与常规非甲基化标志物检测相比,甲基化标志物检测的核心差异在于增加了DNA转化过程。
基于化学试剂的重亚硫酸盐转化技术是目前应用最成熟、最广泛的转化技术。通过重亚硫酸盐处理DNA,将DNA中未甲基化的胞嘧啶(C)转化为尿嘧啶(U),经过 PCR扩增后进一步变成胸腺嘧啶(T),而原本甲基化的 C 保持不变,测序后与标准参考基因组对比,即可区分甲基化状态的不同。
不过,重亚硫酸盐转化会对DNA造成损伤,导致片段化、DNA丢失以及测序数据偏好性等问题。
酶学甲基化测序(EM-seq)通过两组酶促反应检测5mC(5-甲基胞嘧啶)和5hmC(5-羟甲基胞嘧啶):第一阶段反应中,易位双加氧酶 2(TET2)和 T4-噬菌体-β-葡糖基转移酶(T4-BGT)将5mC和5hmC转化为无法被APOBEC3A脱氨基的产物;在第二阶段反应中,APOBEC3A对未修饰的胞嘧啶进行脱氨基处理,将其转化为尿嘧啶。[6]从而实现相对温和转化。
此外,MSRE-PCR技术基于甲基化敏感的限制性内切酶无法切割位点中甲基化修饰序列的原理,无需对序列进行转化。该技术操作简单,DNA 损失少,伴随着酶切效率的进一步优化,将可能是未来甲基化检测有应用潜力的方向之一。[1]
03
PCR及NGS是目前国内DNA甲基化肿瘤标志物检测的核心平台。
其中,已有qPCR及数字PCR检测平台产品获NMPA批准,基于NGS的DNA甲基化多癌早筛产品主要以LDT的形式在院端探索运行,本期着重针对NMPA批准的相关IVD产品做简要分析。
检索DataMed数据库,国内获批的甲基化检测产品共约41款,其中包括1款系统性红斑狼疮辅助诊断试剂,不在本次分析范围内。
共有40款肿瘤辅助诊断相关检测试剂,涉及结直肠癌、宫颈癌、肺癌、尿路上皮癌/膀胱癌、肝癌、食管癌、胃癌、子宫内膜癌、脑胶质瘤共计9个癌种。(附录、图2)
其中,结直肠癌、宫颈癌、肺癌、尿路上皮癌/膀胱癌相关诊断试剂数量相对较多,结直肠癌共计18款产品。(图2)
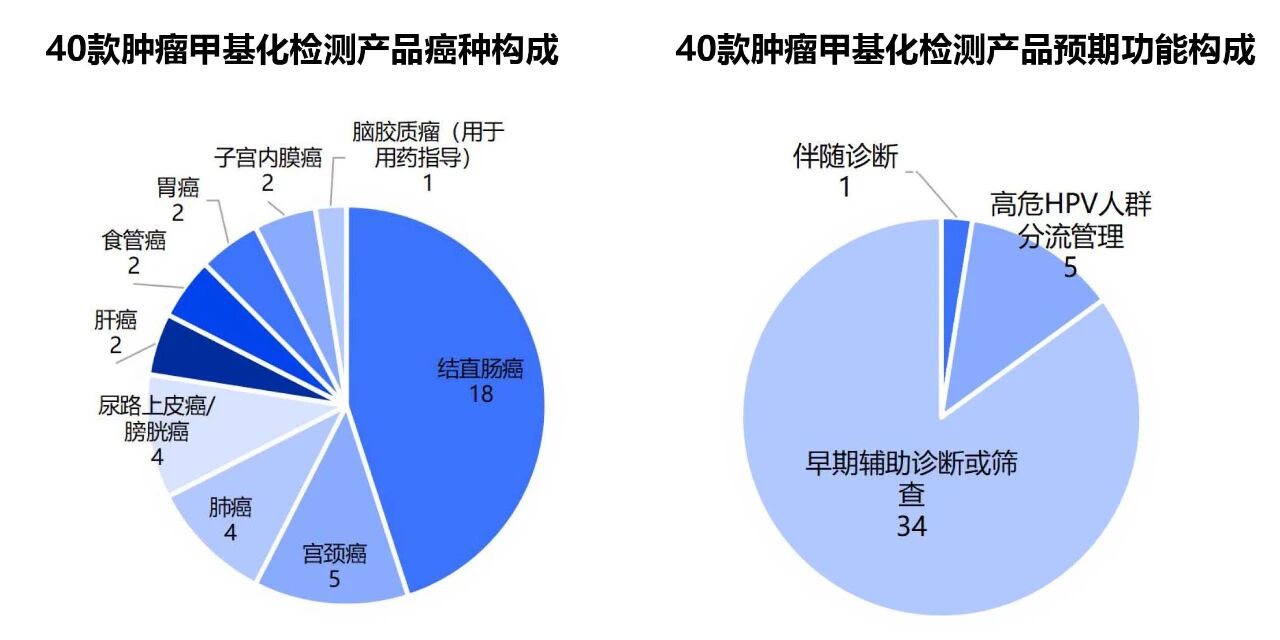
图2 40款甲基化肿瘤检测产品癌种分布情况及预期用途情况
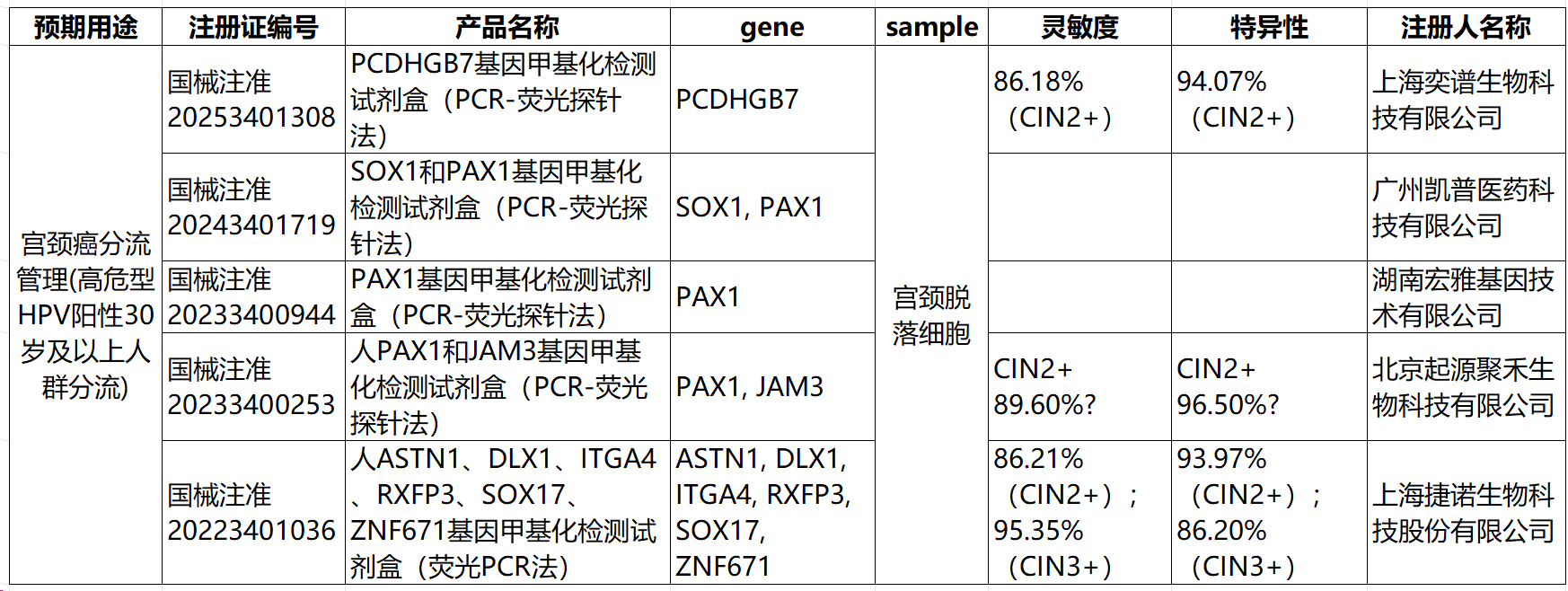
从功能上看,除外1款脑胶质瘤检测产品用于用药指导(伴随诊断),5款宫颈癌相关产品主要用于高危型HPV检测阳性的 30 岁以上女性人群分流管理,剩余34款产品均核心用于肿瘤的早期辅助诊断或高危人群筛查。(图2)
从样本类型上看,血液类样本因取样方便,可用于不便于取样的癌症的早期诊断。目前,已有15款血液检测产品获批,已覆盖结直肠癌、肺癌、肝癌、胃癌、食管癌的早期辅助诊断。(图3)
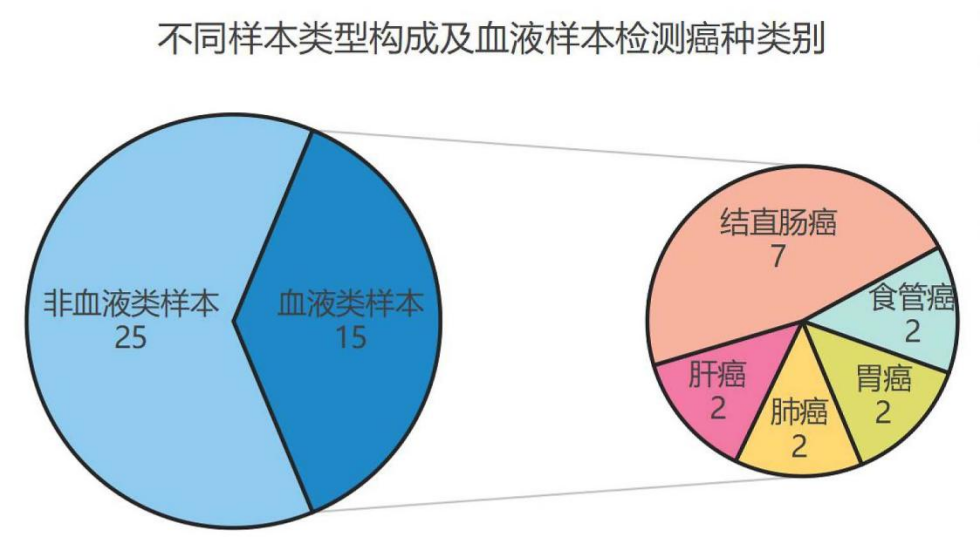
图3 不同样本类型构成及血液样本检测癌种类别
从时间发展趋势看,2015年甲基化肿瘤早期辅助诊断试剂初次获批,针对的癌种为结直肠癌。随后,肺癌、脑胶质瘤、胃癌相关检测产品依次获批。
2022年后,甲基化肿瘤早期辅助诊断产品数量及针对的癌种数量快速增加,2024年获批产品数量达到10款,覆盖7个癌种,2025年至今已有9款产品获批,覆盖7个癌种。(图4)
因此,甲基化肿瘤早期辅助诊断试剂近年来呈现快速发展趋势,表现为单年获批产品数量持续增加,覆盖的癌种类型快速扩大。
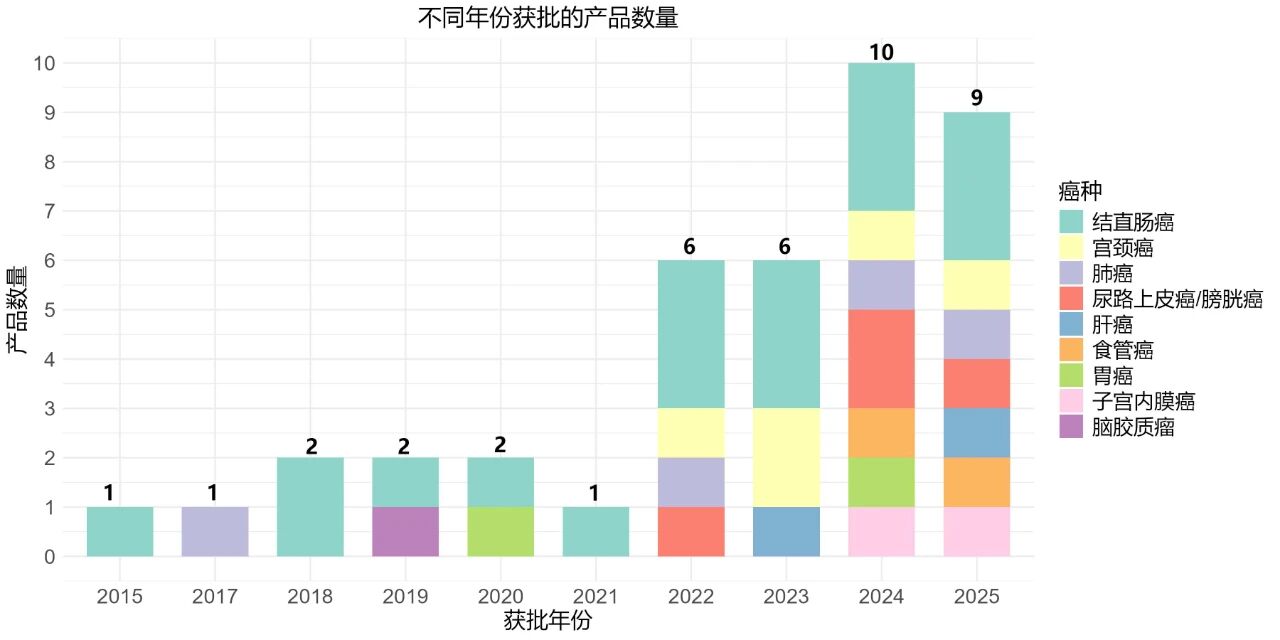
图4 不同年份获批的肿瘤甲基化检测产品数量(根据注册证编号判断)
04
01、检测靶标设计与检测性能
结直肠癌
检测靶标设计上,18款结直肠癌检测产品中选择的目标甲基化基因共 18 个(图5、附录一)。
整体看,除了SDC2为粪便样本核心检测基因、Septin9为血液样本核心检测基因外,不同检测试剂盒间选取的目标基因一致性较低。
说明除了SCD2、Septin9等公认的甲基化检测基因外,不同公司在进行产品设计时往往根据自己的研究和数据,筛选出不同基因的组合。
也侧面说明,目前仍尚未确定结直肠癌甲基化检测公认的最佳基因panel。
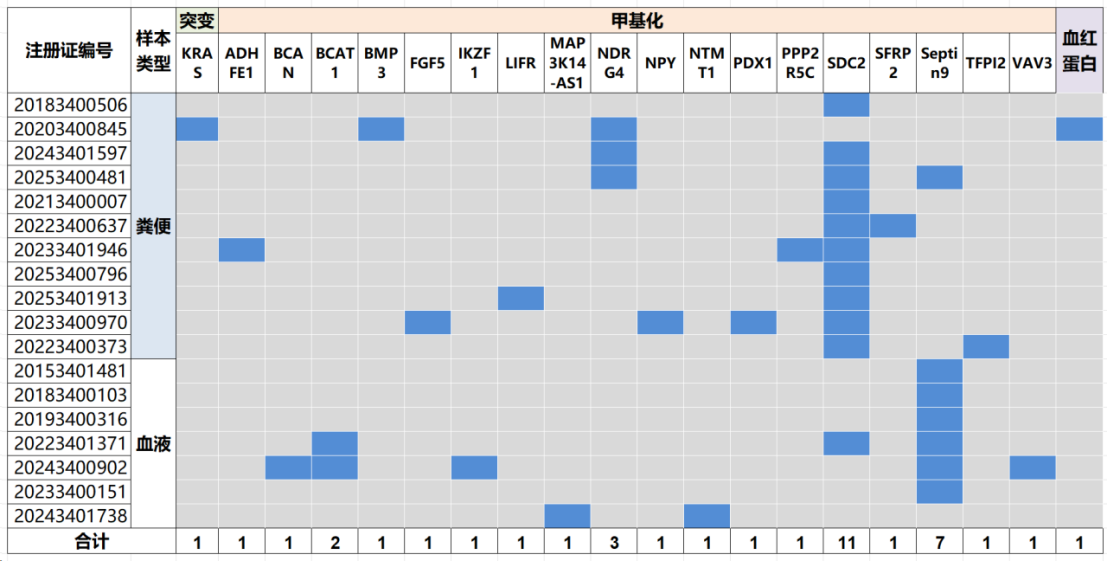
图5 18款结直肠癌早期辅助诊断产品靶标选择情况,蓝色代表该试剂盒选择了该靶标,第二行英文代表对应基因名称。
此外,与其他产品不同,杭州诺辉健康科技 国械注准20203400845产品选择同时检测粪便样本中KRAS突变、BMP3及NDRG4基因甲基化、血红蛋白三类标志物。结合3个层面的信息给出综合评分用于结直肠癌早期筛查的判断。这可能是提高结直肠癌早期筛查检测性能的新思路,但相应也会增加检测的复杂度。
检测性能上,参照审评报告中临床评价性能或公司官网公开的产品检测性能。
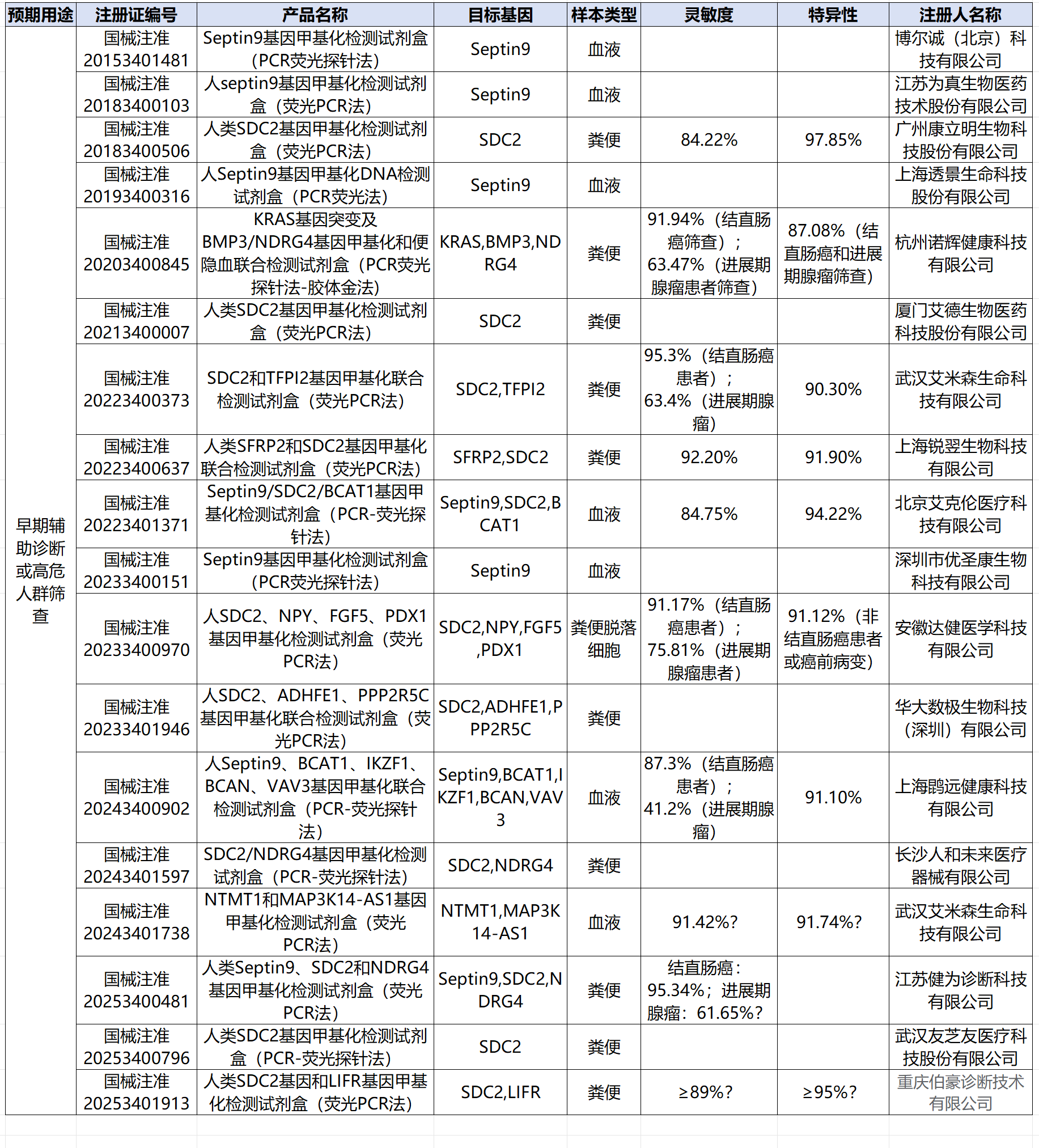
整体看,对于结直肠癌患者,国内产品检测灵敏度范围在84.22% - 95.34%之间,检测特异度范围在87.08% - 97.85%之间。(附录)
对于进展期腺瘤(结直肠癌癌前病变),参考有相关数据的几个产品,检测灵敏度范围在41.2%-75.81%之间,大于粪便免疫化学测试(FIT)。(参考2019年发表的一篇系统综述,FIT对于进展期腺瘤的诊断灵敏度约为40%[2])。
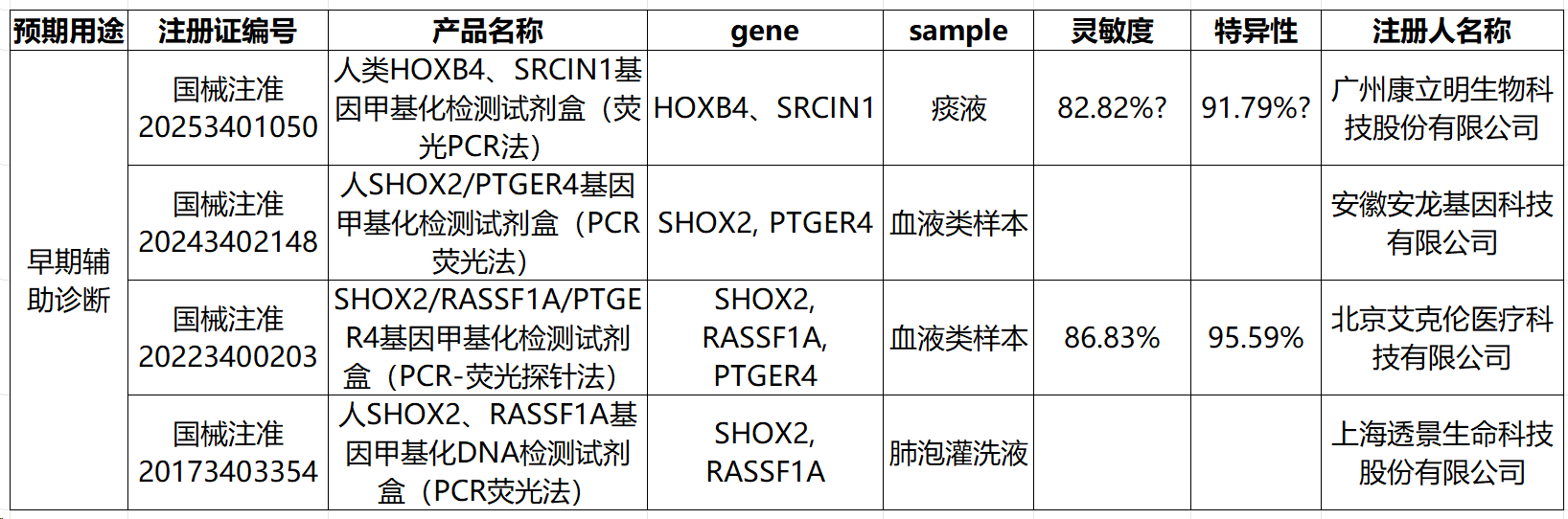
对于其他癌种,在基因选择层面上,与结直肠癌类似,相同癌种不同产品目标基因的选择存在一定差异(肺癌产品一致性相对高,详见附录)。检测性能详见附录,在此不做额外讨论。
02、技术策略选择
40款产品中,已有一款基于数字PCR原理的肝癌早期辅助诊断产品获批(广州优泽生物,国械注准20233400836),从其公开的检测性能看,对于肝癌的诊断灵敏度为95.42%,特异度为96.02%,相对高于其他qPCR检测试剂。
在转化策略选择上,参考公开资料,基于重亚硫酸盐转化技术仍为绝大数试剂盒应用的技术。此外,亦有产品应用MSRE-PCR技术(如上海奕谱生物,国械注准20253401308 宫颈癌分流管理产品)。
05
总之,近年来,基于甲基化的肿瘤检测快速发展,表现为产品数量及产品覆盖的癌种类别快速增加。
截至2025年9月,国内已有 40 款甲基化检测产品应用于肿瘤早期诊断及治疗指导等场景中,其中早期辅助诊断或筛查为核心应用场景。结直肠癌、宫颈癌、肺癌、尿路上皮癌/膀胱癌为产品数量较多的几个癌种。
从样本类型看,基于血液样本的甲基化检测产品已应用于结直肠癌、肺癌、肝癌、胃癌及食管癌的早期诊断中。
整体看,甲基化肿瘤检测产品具有以下特点:
同一癌种下,不同产品选择的目标基因仍普遍存在一定差异。
基于甲基化检测结直肠进展期腺瘤的灵敏度普遍高于粪便免疫化学测试,可能在高危人群早期筛查中有应用潜力。
数字PCR及MSRE-PCR技术已开始逐步应用于甲基化检测及转化中,可能会进一步提高检测的准确性及稳定性。
此外,国内外已有多款基于甲基化的多癌种早筛检测产品,下期我们将聚焦讨论甲基化泛癌检测,欢迎持续关注。
附录


参考文献
[1]中国抗癌协会肿瘤标志专业委员会 肿瘤DNA甲基化标志物检测及临床应用专家共识(2024版)
[2]Imperiale TF, Gruber RN, Stump TE, Emmett TW, Monahan PO. Performance Characteristics of Fecal Immunochemical Tests for Colorectal Cancer and Advanced Adenomatous Polyps: A Systematic Review and Meta-analysis. Ann Intern Med. 2019 Mar 5;170(5):319-329.
[3]Papanicolau-Sengos A, Aldape K. DNA Methylation Profiling: An Emerging Paradigm for Cancer Diagnosis. Annu Rev Pathol. 2022 Jan 24;17:295-321.
[4]Saha D, Kanjilal P, Kaur M, Menon SV, Ashraf A, Kumar MR, Alqahtani T, Atteri S, Uti DE, Dhara B. Transforming Cancer Diagnostics: The Emergence of Liquid Biopsy and Epigenetic Markers. MedComm (2020). 2025 Sep 14;6(9):e70388.
[5]Dor Y, Cedar H. Principles of DNA methylation and their implications for biology and medicine. Lancet. 2018 Sep 1;392(10149):777-786.
[6]Vaisvila R, Ponnaluri VKC, Sun Z, Langhorst BW, Saleh L, Guan S, Dai N, Campbell MA, Sexton BS, Marks K, Samaranayake M, Samuelson JC, Church HE, Tamanaha E, Corrêa IR Jr, Pradhan S, Dimalanta ET, Evans TC Jr, Williams L, Davis TB. Enzymatic methyl sequencing detects DNA methylation at single-base resolution from picograms of DNA. Genome Res. 2021 Jul;31(7):1280-1289.




发表评论 取消回复