王金博士报告分享《CRISPR诊断技术的研究进展及应用展望》

CRISPR技术最初因CRISPR-Cas9基因编辑功能受到广泛关注,并荣获2020年度诺贝尔化学奖。其应用领域已从基因编辑拓展至诊断领域,形成CRISPR诊断(CRISPR-Dx)技术。
此前,北京、无锡已成功举办两期“CRISPR诊断技术创新与转化”专题会,本文基于第三期专题会内容,系统阐述CRISPR-Dx的核心原理、技术特点、关键难题、标准化建设及应用前景,为该技术的研发与转化提供参考。

01
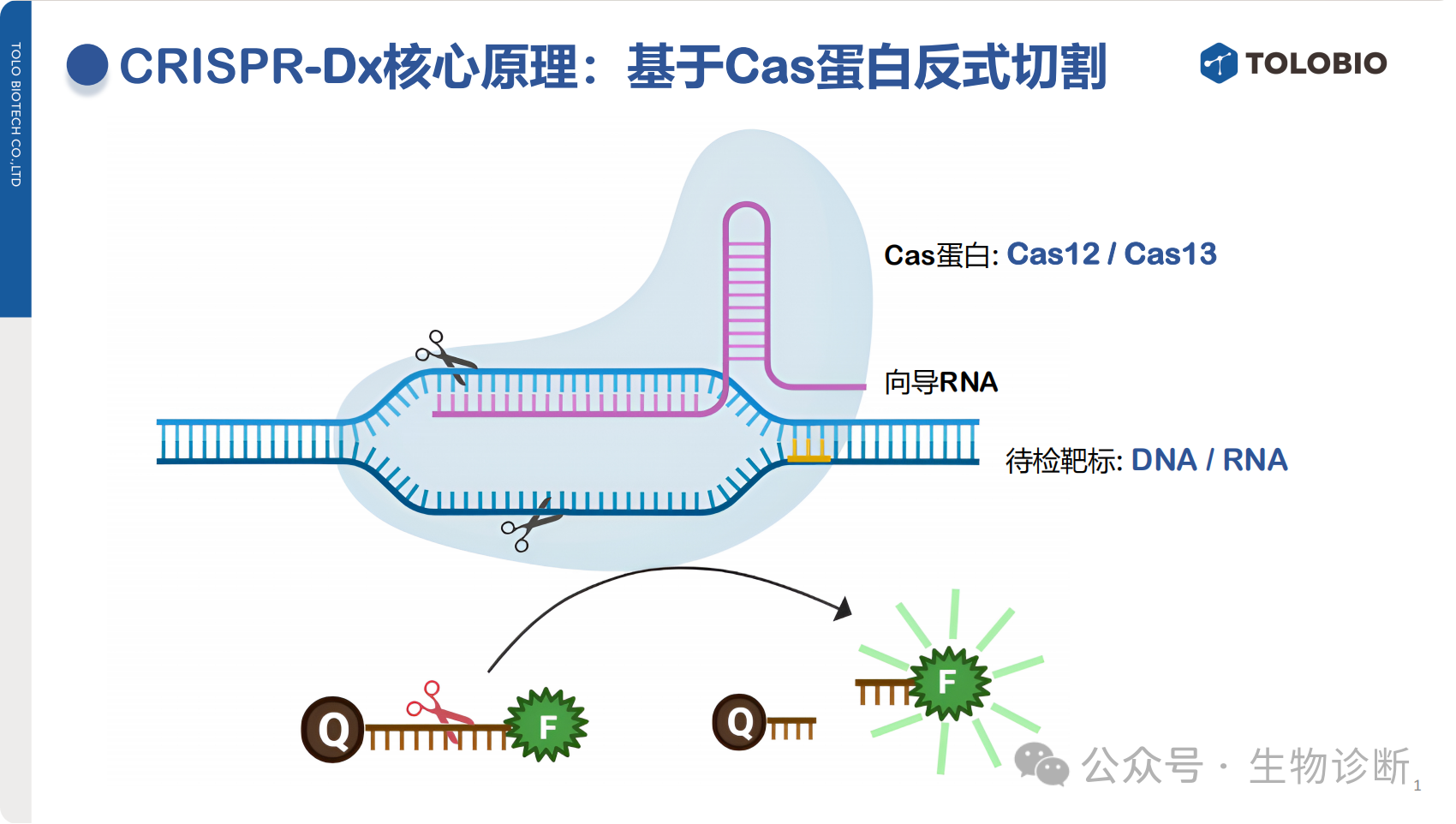
CRISPR-Dx的核心机制是利用Cas蛋白(主要为Cas12/Cas13)的反式切割活性。其基本逻辑如下:
向导RNA可精准引导Cas蛋白识别目标靶标(DNA或RNA);
Cas蛋白与靶标结合后被激活,释放非特异性的“乱切”活力,能够切割体系中不配对的单链核酸;
该活性可被用于开发报告系统,通过探针切割后的信号释放(如荧光、显色等)实现靶标的检测。
广义上,所有利用CRISPR系统进行靶标核酸或非核酸检测的技术均属于CRISPR诊断,本次聚焦于基于Cas蛋白反式切割活性建立的诊断体系。
02
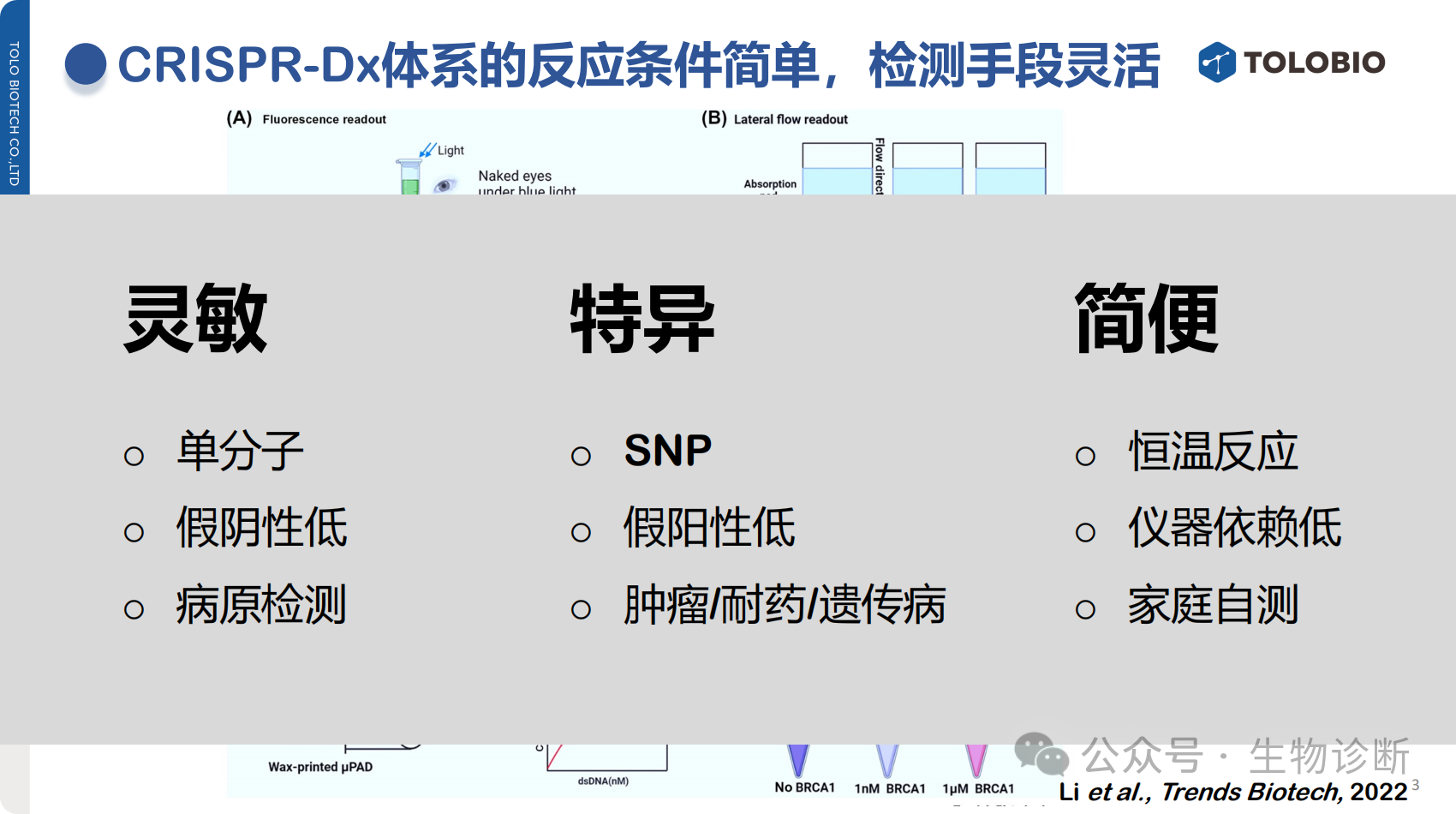
2.1 反应条件简便
无需复杂设备,恒温条件下即可完成反应;
靶标识别具有高度灵活性,仅需设计与靶标互补的向导RNA。
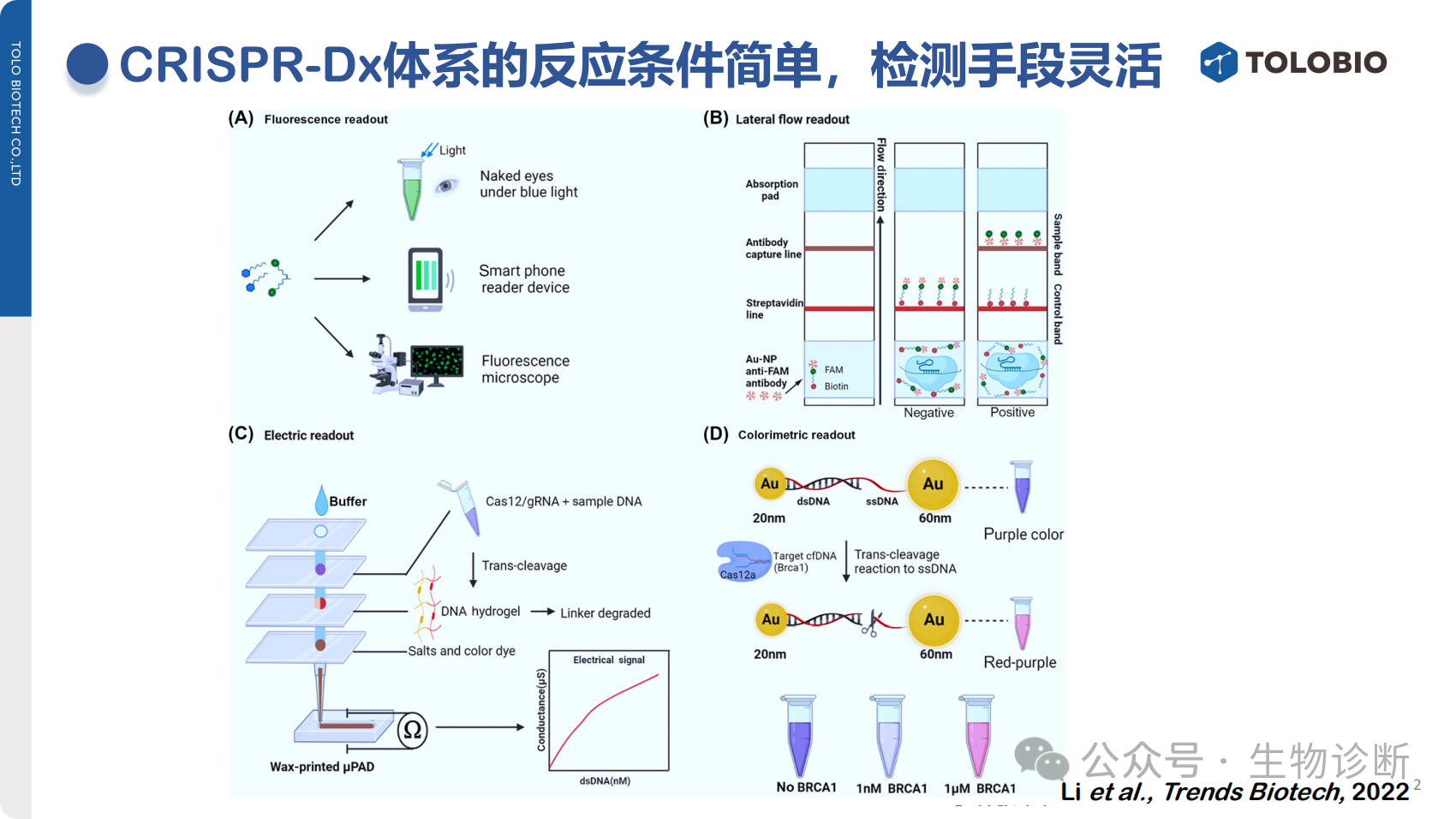
2.2 检测手段多样
CRISPR-Dx可与多种信号输出系统结合,实现灵活检测:
荧光信号检测:通过检测体系荧光强度判断阴阳性;
侧向流层析(试纸条):通过条带数量判定结果;
电化学检测:基于电化学信号变化实现靶标检测;
显色检测:直接观察体系颜色变化判断结果;
其他:可与拉曼光谱等技术联用拓展检测场景。
2.3 核心技术优势
高灵敏度:结合扩增技术可实现单分子检测,信号可通过探针切割持续放大,假阴性率低,适用于病原检测等场景;
高特异性:可精准识别单碱基差异(SNP),源于CRISPR基因编辑的精准定位能力,假阳性率低,适用于耐药突变、肿瘤筛查、遗传病检测等场景;
低仪器依赖:恒温反应特性降低了对检测设备的要求,为家庭自测等场景提供可能。
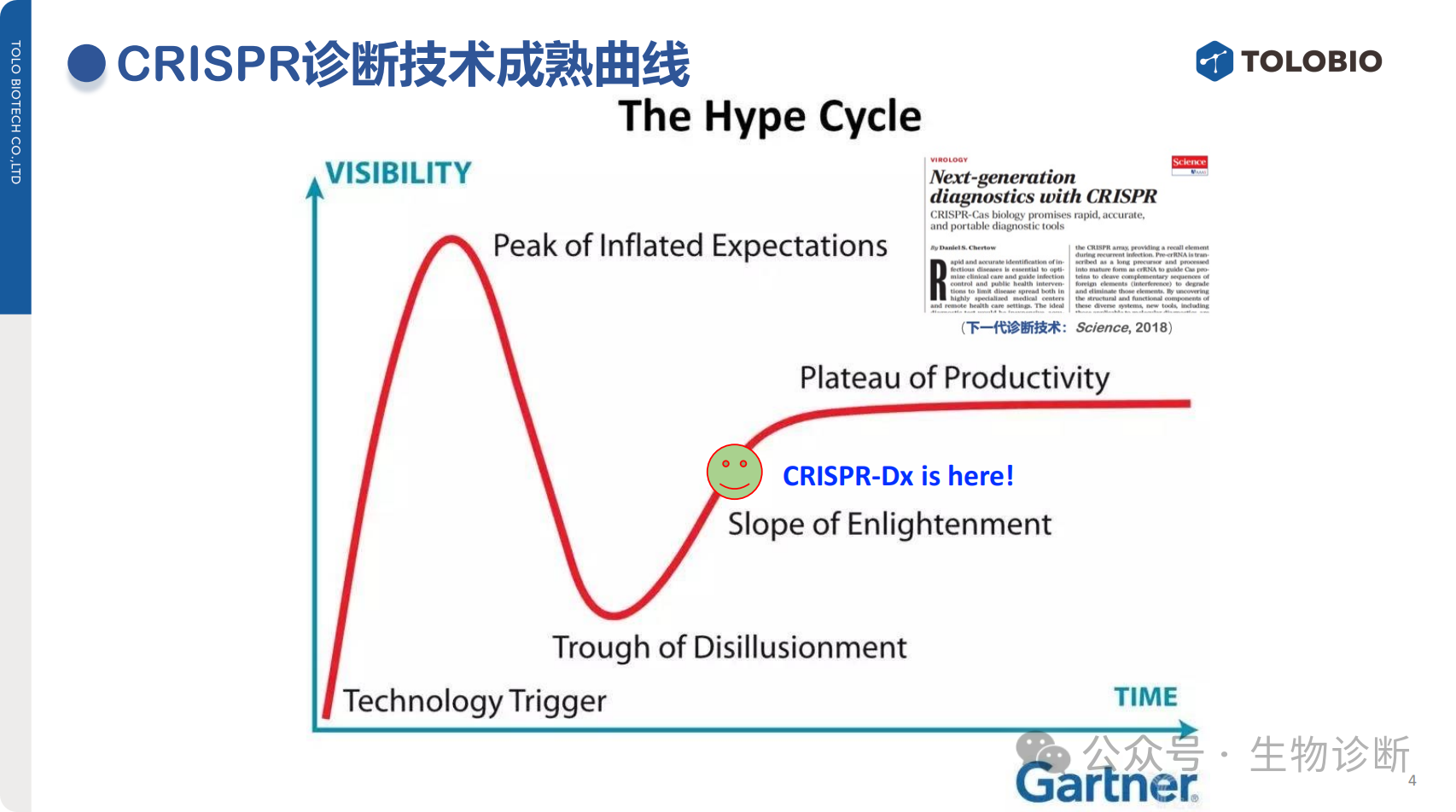
2.4技术成熟曲线分析
CRISPR-Dx的发展符合加特纳(Gartner)技术成熟曲线:
技术触发期(2016-2017年):技术诞生后迅速引发关注,《Science》将其评为“下一代诊断技术”;
期望膨胀期:初期因技术新颖性获得广泛关注,但同时面临质疑(如“PCR可替代”、“操作复杂”、“成本高”、“不定量”等问题);
幻灭低谷期:经历质疑后,行业逐渐回归理性,技术价值被重新认知;
启蒙斜坡期:当前CRISPR-Dx已接近临床应用水平,技术逐步成熟,类比30年前PCR技术的发展阶段(PCR1983年发明,1995年实现产业化爆发),CRISPR-Dx仍处于发展早期,未来潜力巨大。
03
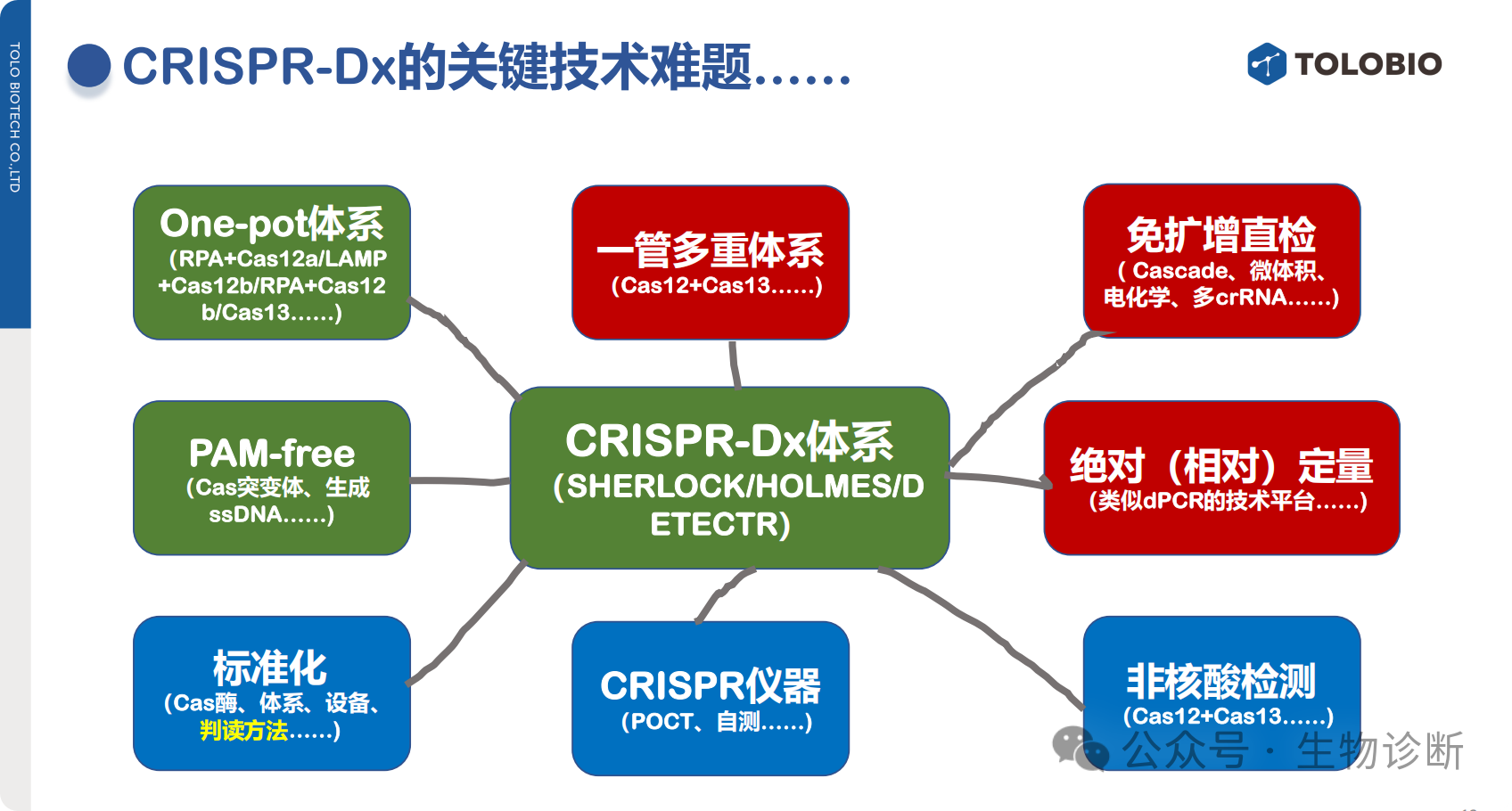
3.1 底层检测系统
已建立基于反式切割活性的核心系统:
基于Cas13的SHERLOCK系统;
基于Cas12的HOLMES系统(吐露港生物王金团队发明)
基于Cas12的DETECTR系统(Jennifer Doudna团队开发)
3.2 一管法(one-tube)/一锅法(one-pot)/一步法(one-step)体系
定义区分:
一管法(one-tube):封闭管子或芯片内完成反应,可物理分隔,无需开盖;
一锅法(one-pot):反应物物理混合,可分步反应;
一步法(one-step):需满足一管、一锅、同步反应;
技术进展:one-pot体系已相对成熟,主流方案包括RPA+Cas12a、RPA+Cas12b、LAMP+Cas12b等,可避免开盖导致的气溶胶污染。

3.3 PAM限制突破
通过Cas蛋白突变体改造、产物单链化等方法,突破CRISPR识别靶标时对PAM序列的依赖,实现任意位点检测。
3.4 多重检测体系
现有进展:2018年张峰团队构建四酶、四gRNA、四种报告的一管四重体系(复杂度高,尚未实际应用);一管两重体系(Cas12+Cas13)已实现简便应用;
发展方向:攻克单酶多探针多重检测技术,减少体系中蛋白数量,提升检测稳定性与可调节性。
3.5 定量检测技术
技术瓶颈:CRISPR为恒温反应,无PCR的“cycle”概念,相对定量能力弱于PCR;
建议方案:
明确CRISPR具备定量潜力(仅定量精度差异,非不能定量);
结合数字PCR的微液滴系统,通过泊松分布算法实现绝对定量;
探索Tt值(恒温扩增常用指标)、Ct值(CRISPR-TB方法)、终点法信号值等定量判据。
3.6 免扩增核酸检测技术
核心优势:省试剂、省时间、无气溶胶污染、操作简便,可实现现场分子诊断;
研发方向:
Cas酶级联放大(如Cas12+Cas13协同放大信号);
多crRNA探针设计(单个靶标匹配多个crRNA,信号倍增);
与电化学等平台联用,结合Cas突变体优化、反应buffer改良等技术组合。
3.7 非核酸靶标检测
技术原理:通过特定识别系统将非核酸靶标(蛋白、金属离子、代谢物等)的信号转换为Cas蛋白切割活性的调控信号(影响activator靶标核酸、CRISPR复合物或Cas蛋白本身活力);
技术优势:结合CRISPR的高信号放大能力与免疫检测等方法,显著提升检测灵敏度,有望改变现有免疫诊断格局(包括化学发光市场);
应用场景:覆盖临床诊断、生命科学、食品科学、环境监测等领域,满足快速、现场检测需求。

3.8 专用仪器与芯片
当前可借助恒温扩增仪器等设备,未来需开发针对CRISPR技术特性的专用仪器及芯片,降低检测门槛。
04
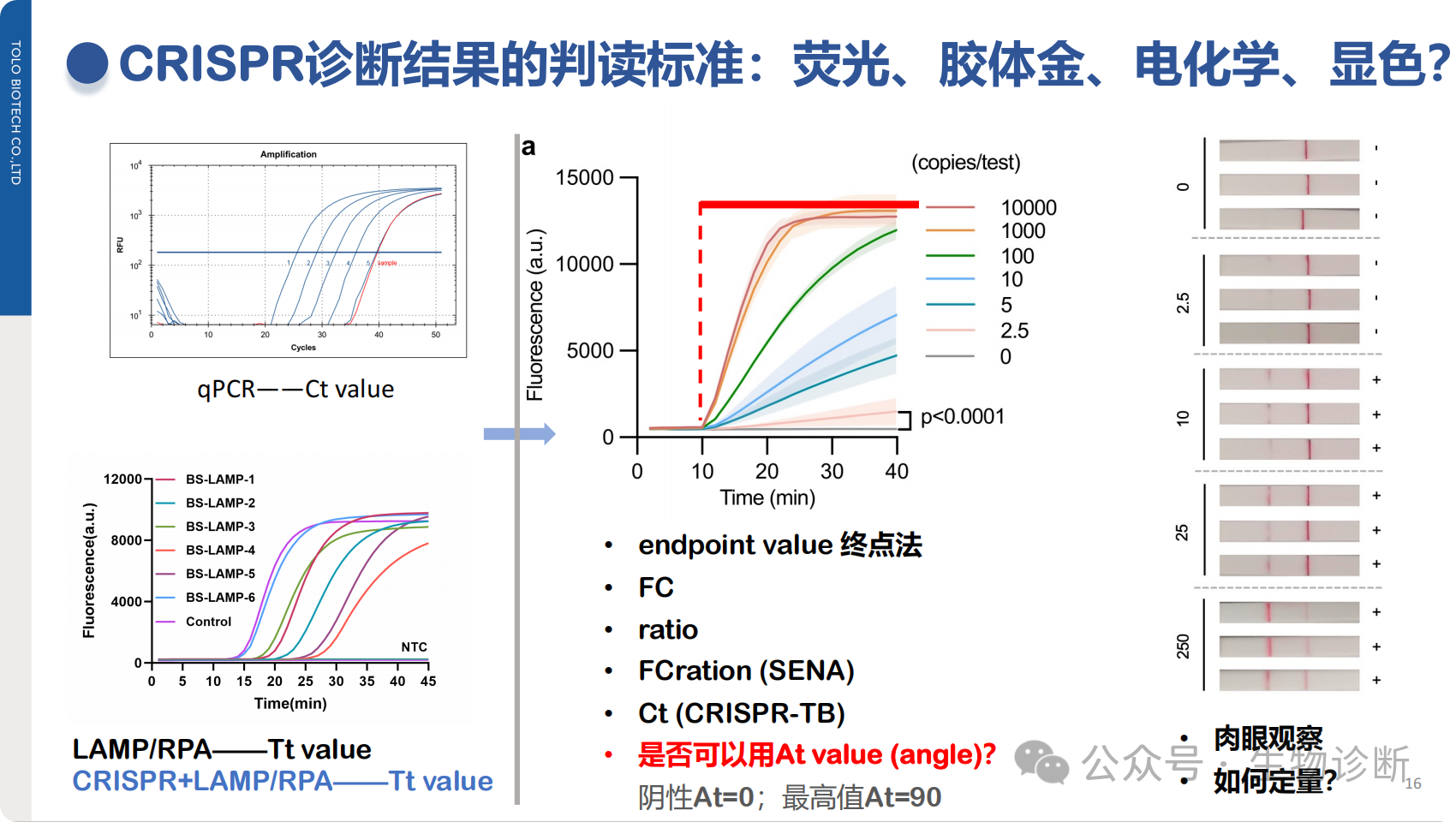
4.1 结果判读标准化
现有问题:判读方法多样(荧光强度、胶体金肉眼观察、电化学信号等),缺乏统一标准;
可能方案:
与等温扩增结合的体系:采用Tt值(峰出现时间,值越小靶标浓度越高);
信号饱和体系:引入At值(角度值,阴性为0°,信号饱和为90°);
通用判据:终点法(固定时间点信号阈值)、fold change(信号变化倍数,如≥2-3倍为阳性);
胶体金检测:建立客观判读标准,避免人为误差。
4.2 Cas酶标准化
现存问题:当前科研与产品中Cas蛋白以浓度单位(ng/pmol)计量,导致不同批次、不同厂家产品活力不一致,实验重复性差;
解决方案:
定义活力单位“transU”:37℃、1分钟内切割1pmol探针的酶量;
吐露港生物联合相关单位制定CRISPR诊断领域首个国家标准(2025年立项通过),2026年起提供的Cas蛋白将标注transU活力单位,推动行业统一。

05
5.1 核心应用场景
1.个人自测场景:非专业人士可操作、便携式检测(涵盖人及非人应用),需解决气溶胶污染问题;
2.临床核酸检测:针对现有技术检测灵敏度不足的项目(如病原体检测、肿瘤筛查),利用CRISPR高特异性提升检测性能;
3.非核酸检测:应用潜力与核酸检测相当,成为现有免疫技术的有力竞争者;
4.免扩增直检:技术成熟后将引发临床与自测领域的革命性变化,实现快速、无污染的分子诊断。

5.2 发展趋势类比
参考现代化办公设备演变(台式机→笔记本→服务器→智能手机),分子诊断技术呈现“便捷化、移动化”趋势:
PCR(台式机):开启分子诊断时代,但需分区实验室,操作复杂;
POCT(笔记本):浓缩PCR核心功能,便携性提升,可灵活移动检测;
NGS(服务器):解决高通量、大数据检测需求;
CRISPR-Dx(智能手机):实现个人自测,满足“随时、随地、任何人”的检测需求,未来有很大应用潜力。


5.3 理想居家自测产品特性
安全:使用安全、环境友好(防气溶胶污染,如COMPASS技术);
简便:支持试纸条或小型仪器,无需专业操作;
快速:检测时间<20分钟;
经济:价格控制在10-20元;
精准:结合等温扩增与CRISPR技术,兼具高灵敏度与高特异性。

06
CRISPR-Dx凭借高灵敏度、高特异性、简便快捷等核心优势,已从技术探索阶段逐步迈向临床转化与产业化应用。当前,行业需聚焦多重检测、免扩增直检、标准化建设等关键技术难题,通过跨领域合作与技术创新突破瓶颈。未来,随着技术成熟与产品迭代,CRISPR-Dx将在个人自测、临床诊断、非核酸检测等领域实现广泛应用,推动分子诊断行业进入“便捷化、大众化”的新时代。吐露港生物将持续以专利授权、原料供应、技术服务为核心,与全球合作伙伴共建CRISPR诊断产业生态,助力技术转化与全球健康问题解决。
07
在此简要介绍吐露港生物的发展情况。
公司以"基于CRISPR创新科技解决全球健康威胁"为使命,致力于推动检测技术向更简便的方向发展。ToloBio拥有CRISPR诊断领域的底层专利和方法学专利,并积极构建CRISPR诊断产业生态。作为开放型创新平台,公司秉持合作共赢理念,为行业伙伴提供核心原料和整体解决方案。






发表评论 取消回复