复旦大学王瑞副研究员报告:《CRISPR分子诊断方法用于多种类生物标志物检测》。

2025年12月21日,由中国医药生物技术协会生物诊断技术分会主办,第三期“生物诊断前沿技术专题会”在复旦大学召开。专题会聚焦《CRISPR诊断技术的创新与转化》。
生物诊断公众号将对各专家汇报内容进行汇编整理,供关注CRISPR诊断技术的业内同仁学习参考。
本期分享复旦大学王瑞副研究员报告:《CRISPR分子诊断方法用于多种类生物标志物检测》。

01
人类表型组国际大科学计划旨在通过跨尺度、多维度的表型测量,建立基因-环境-表型之间的关联网络,从而发现指征健康与疾病的生物标志物和新药靶标。本团队的研究聚焦于该计划的“控”环节,即基于发现的生物标志物,开发新型生物诊断方法,以促进精准医疗的转化落地。
CRISPR-Cas系统因其高分辨率、高特异性、可编程性以及简便快捷等特点,被誉为下一代分子诊断技术。然而,其在实际应用中仍面临三大瓶颈:
(1) Cas酶工具有限,存在PAM序列限制、脱靶效应及不耐高温等问题;
(2) 核酸(DNA/RNA)一体化检测困难;
(3) 非核酸靶标(如蛋白、代谢物)检测难以实现。
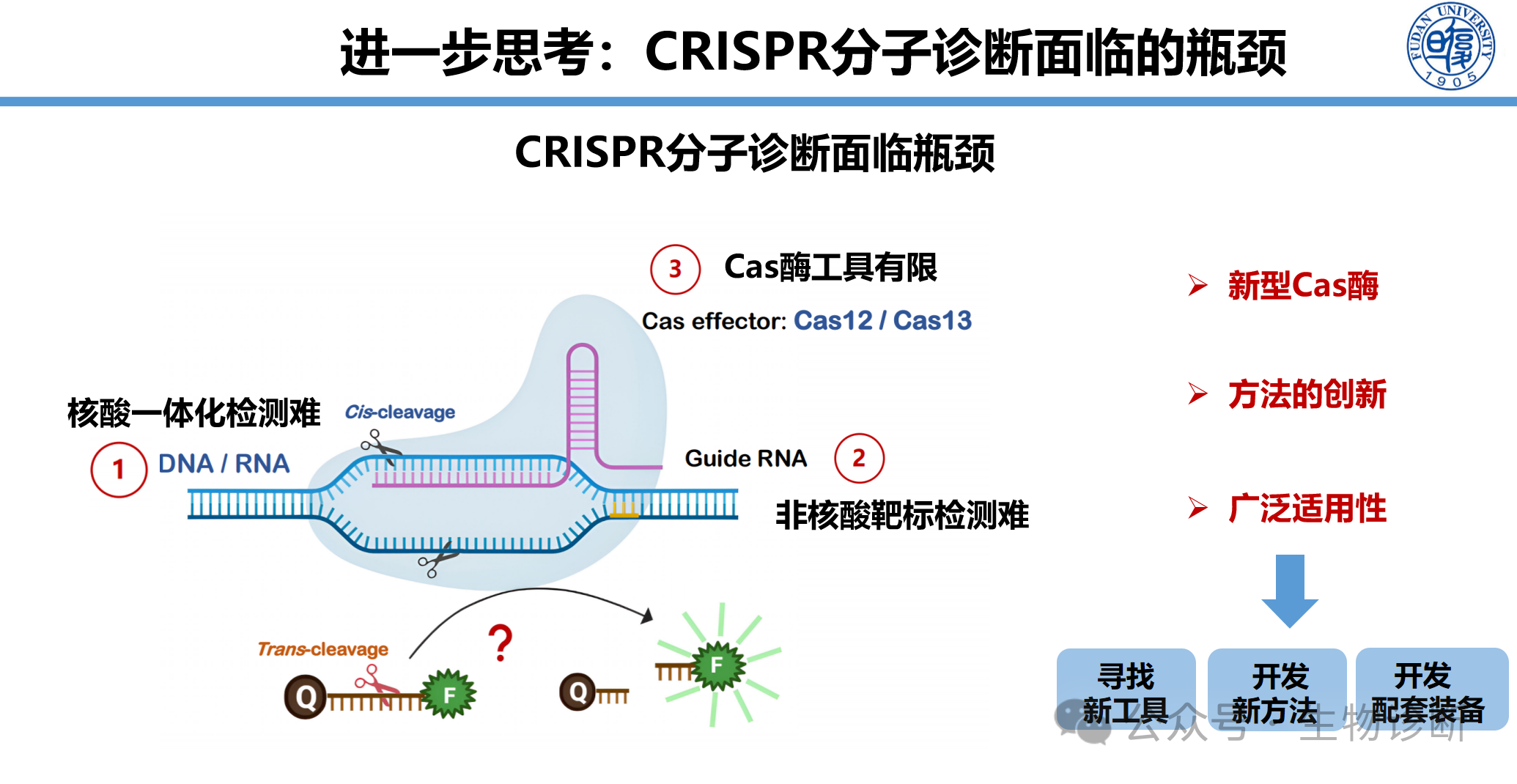
为此,本团队围绕“新工具、新方法、新装备”三个层面开展研究,旨在拓展CRISPR技术的应用范围,提升其检测性能与可及性,最终实现从核酸到非核酸、从单靶标到多靶标、从实验室到现场(POCT)的分子诊断技术革新。
02
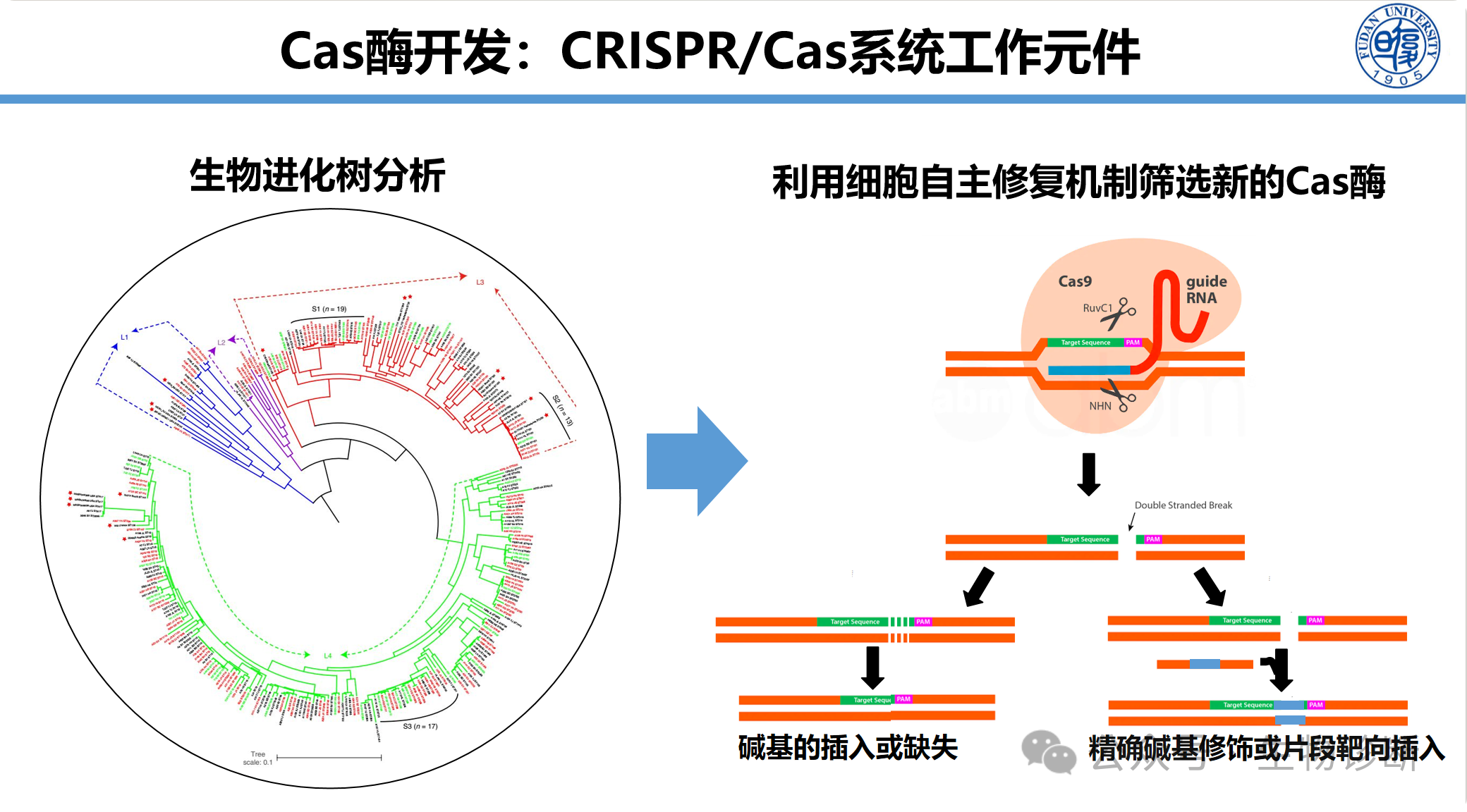
2.1 新型Cas酶的筛选与开发
通过生物信息学分析现有Cas酶同源序列,利用细胞自主修复机制筛选新Cas酶。
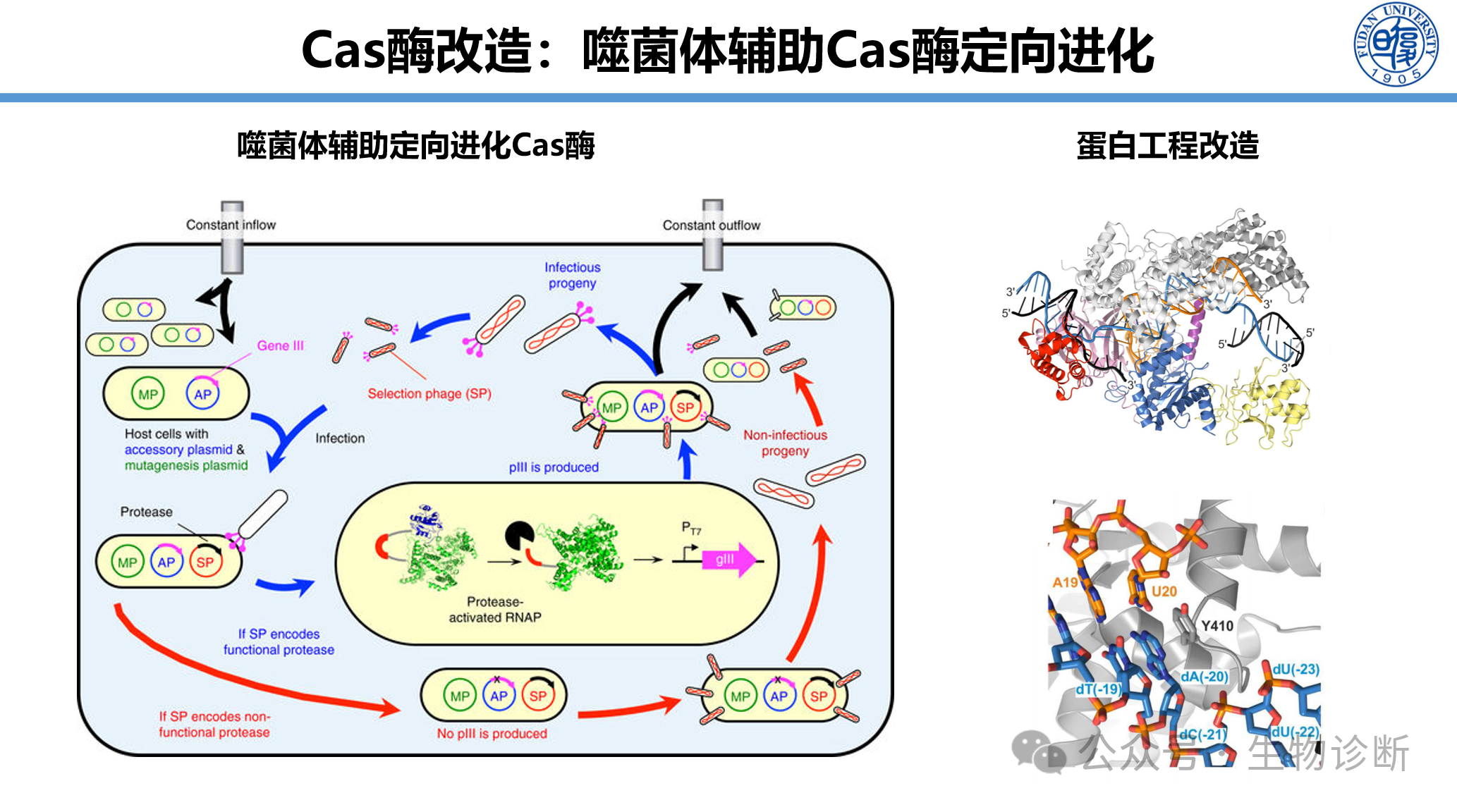
2.2 Cas酶的定向进化与工程改造
噬菌体辅助定向进化:将目标蛋白与抑制系统融合表达于噬菌体,在进化过程中产生突变文库。活性提升的突变体可解除抑制,恢复噬菌体外壳蛋白表达并释放子代噬菌体,通过多轮筛选获得性能优化的Cas酶。
蛋白工程改造:识别关键氨基酸位点进行定点突变,显著提升编辑/检测效率与特异性,降低脱靶率。
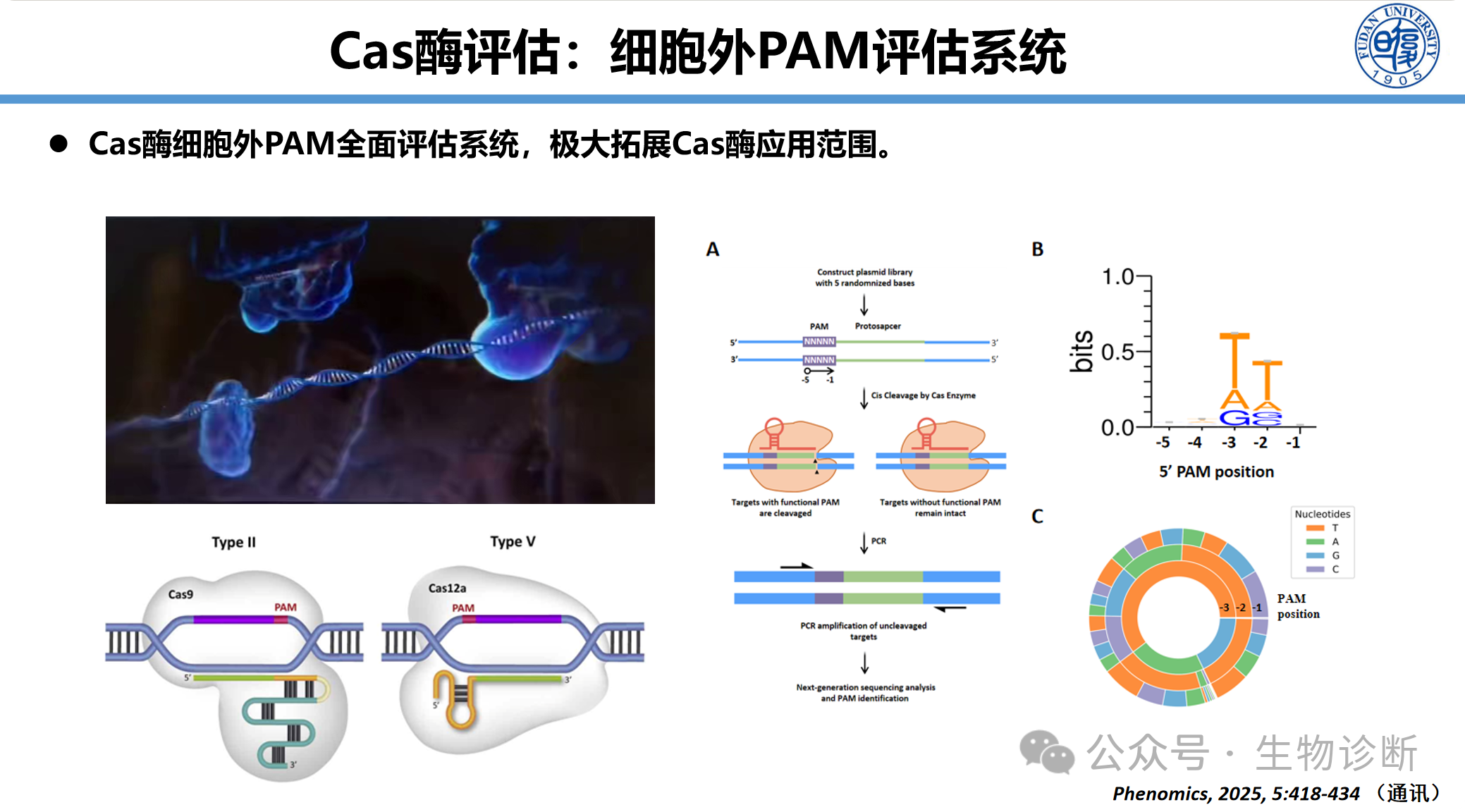
2.3 Cas酶PAM特性全面评估系统
为扩大Cas酶的应用范围,特别是减少对PAM序列的依赖,开发了细胞外全面评估PAM的系统。该方法构建了一个在gRNA识别靶标前包含5个随机碱基(N)的PAM序列文库。当Cas酶-gRNA复合物识别并切割具有活性PAM的序列后,对切割产物加尾并进行二代测序,从而全面鉴定该酶所能识别的PAM序列谱。此方法不仅能验证已知PAM,还可能发现新的、更灵活的PAM选择,极大拓展了工具的适用范围。
从而自主开发了应用范围更广、特异性更强、活性更高的CRISPR/Cas新工具酶,真正实现了源头创新。
03
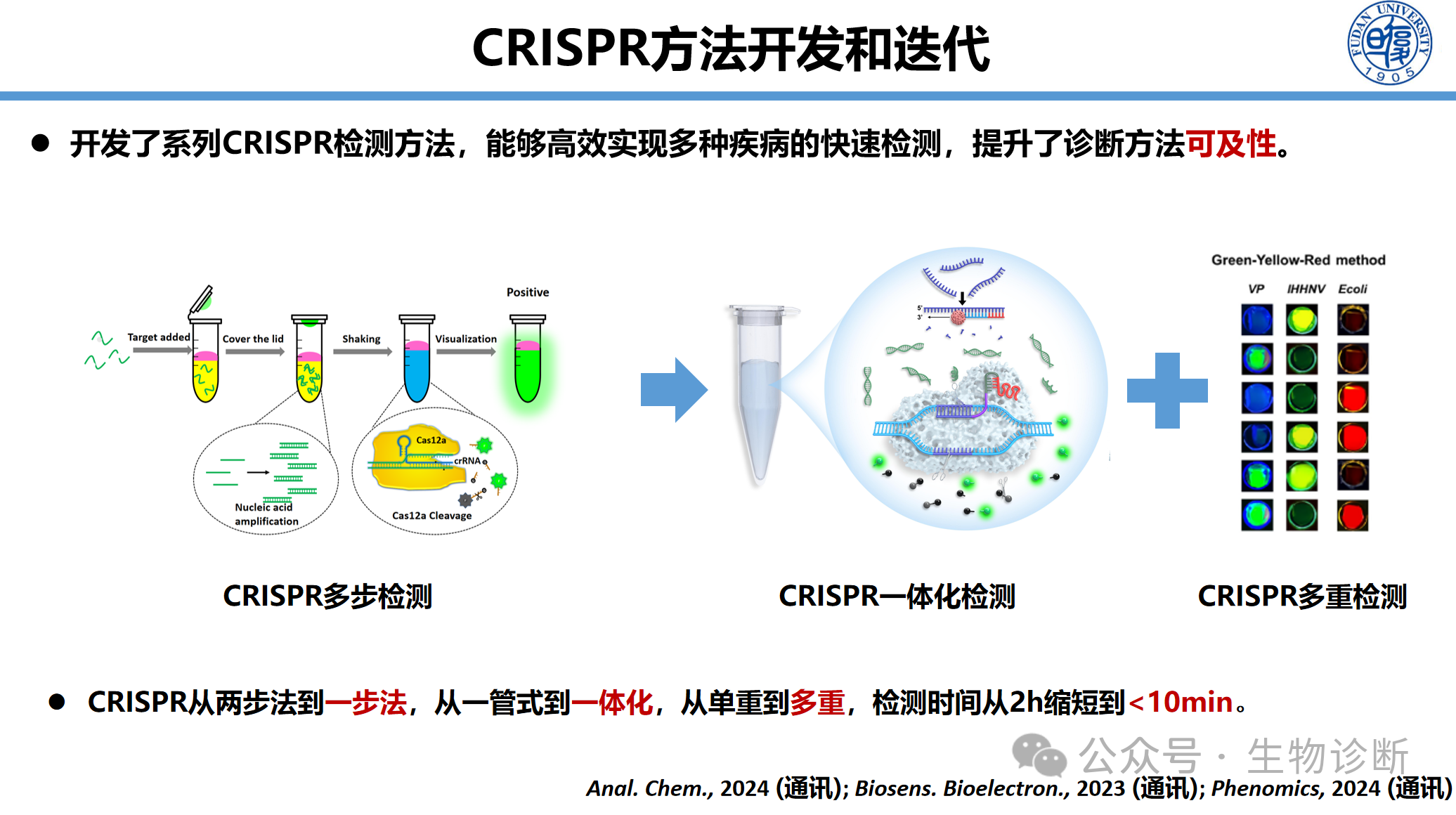
3.1 检测方法迭代升级
CRISPR检测方法实现三步关键进化:
从两步法到一步法:扩增与检测反应在一管内完成
从一管式到一体化:真正实现"样本进-结果出"
从单重到多重:单管同步检测多靶标
时间缩短:从2小时降至<10分钟
这些进展使得检测能在单一恒温条件下完成,极大提高了可及性,为基层社区应用乃至居家自检提供了可能。
3.2 核酸标志物检测
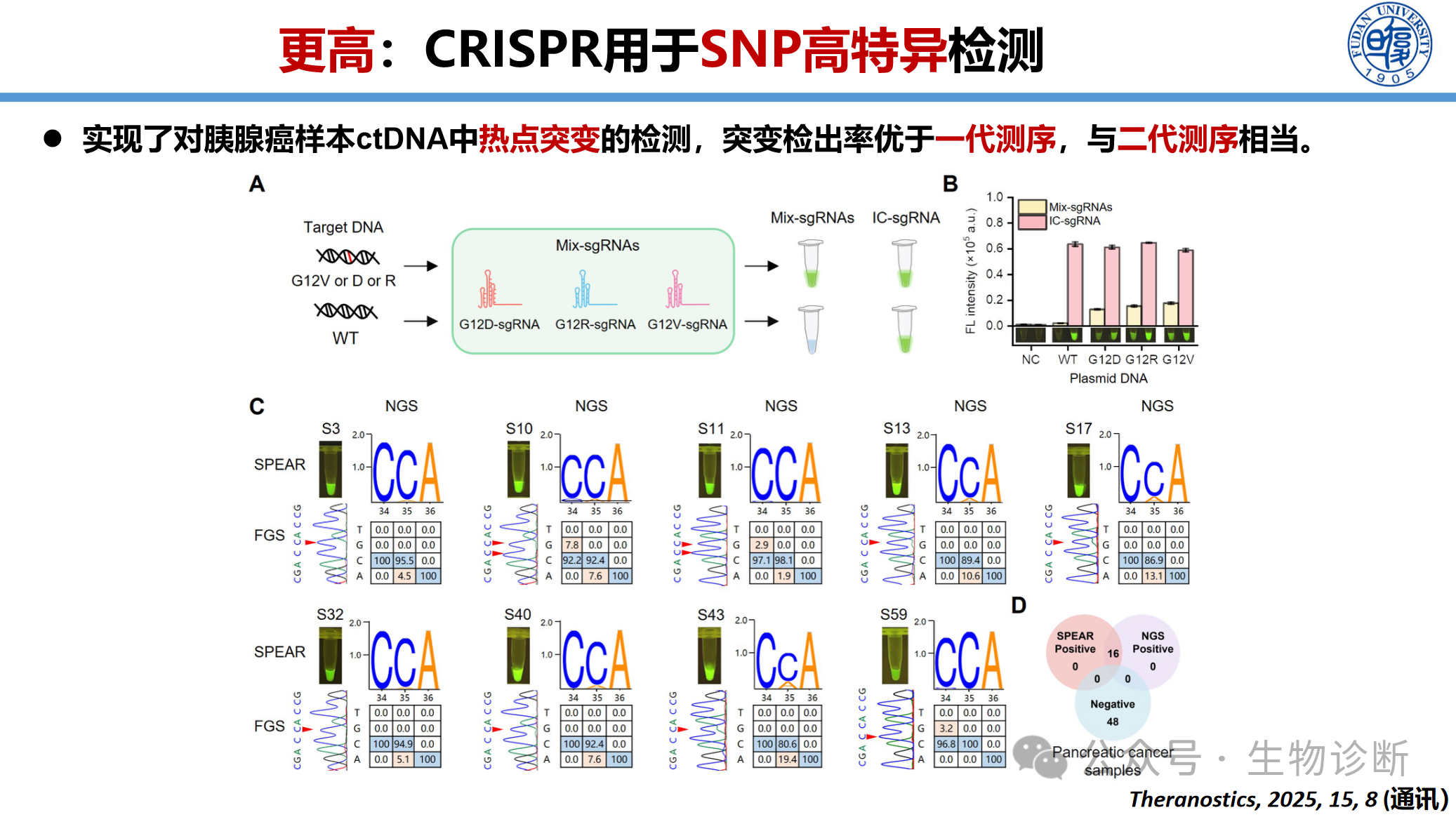
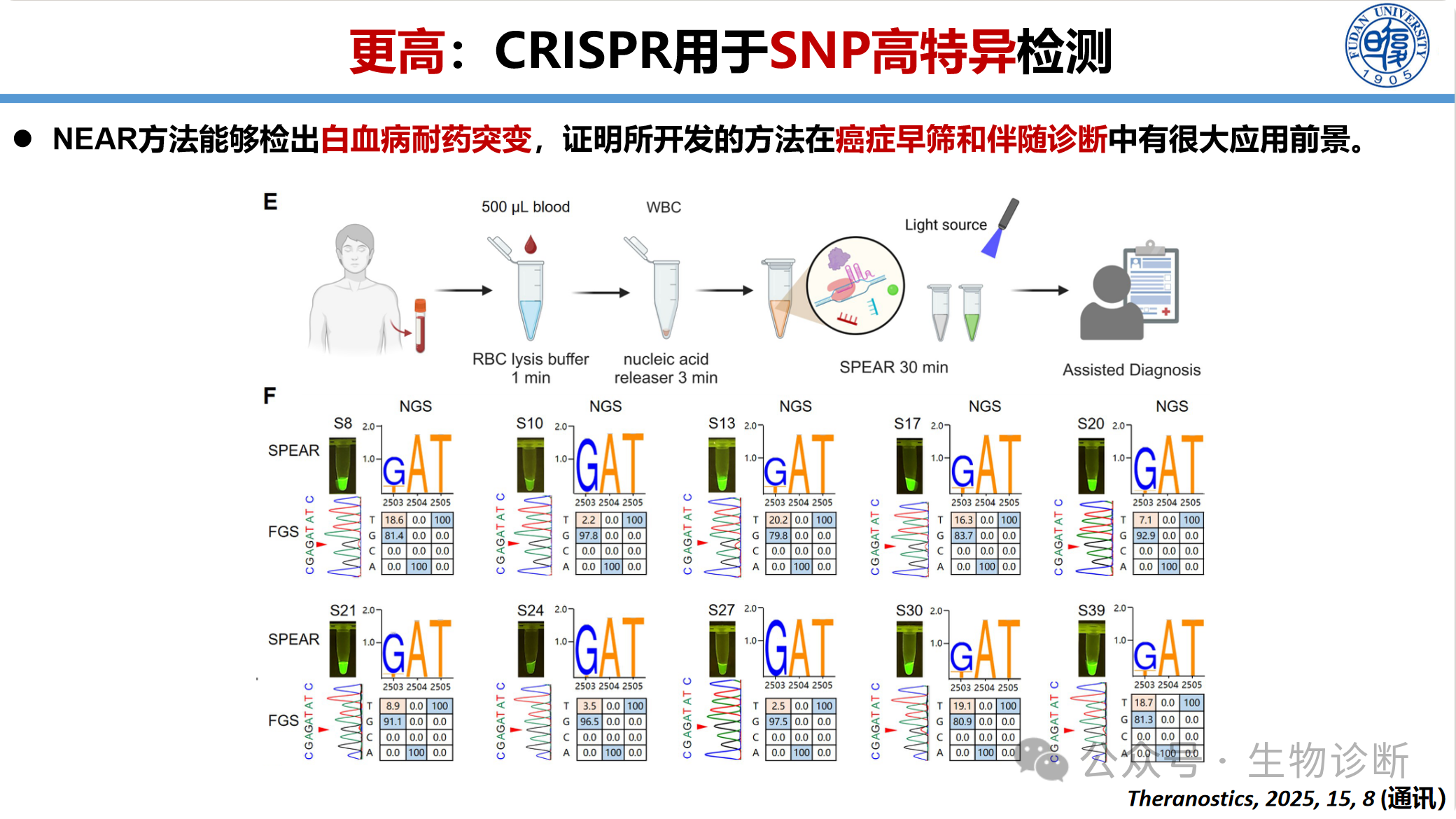
3.2.1 SNP高特异检测(SPEAR方法)
开发NEAR与CRISPR结合的一体化检测方法(SPEAR),用于癌症早筛和伴随诊断。
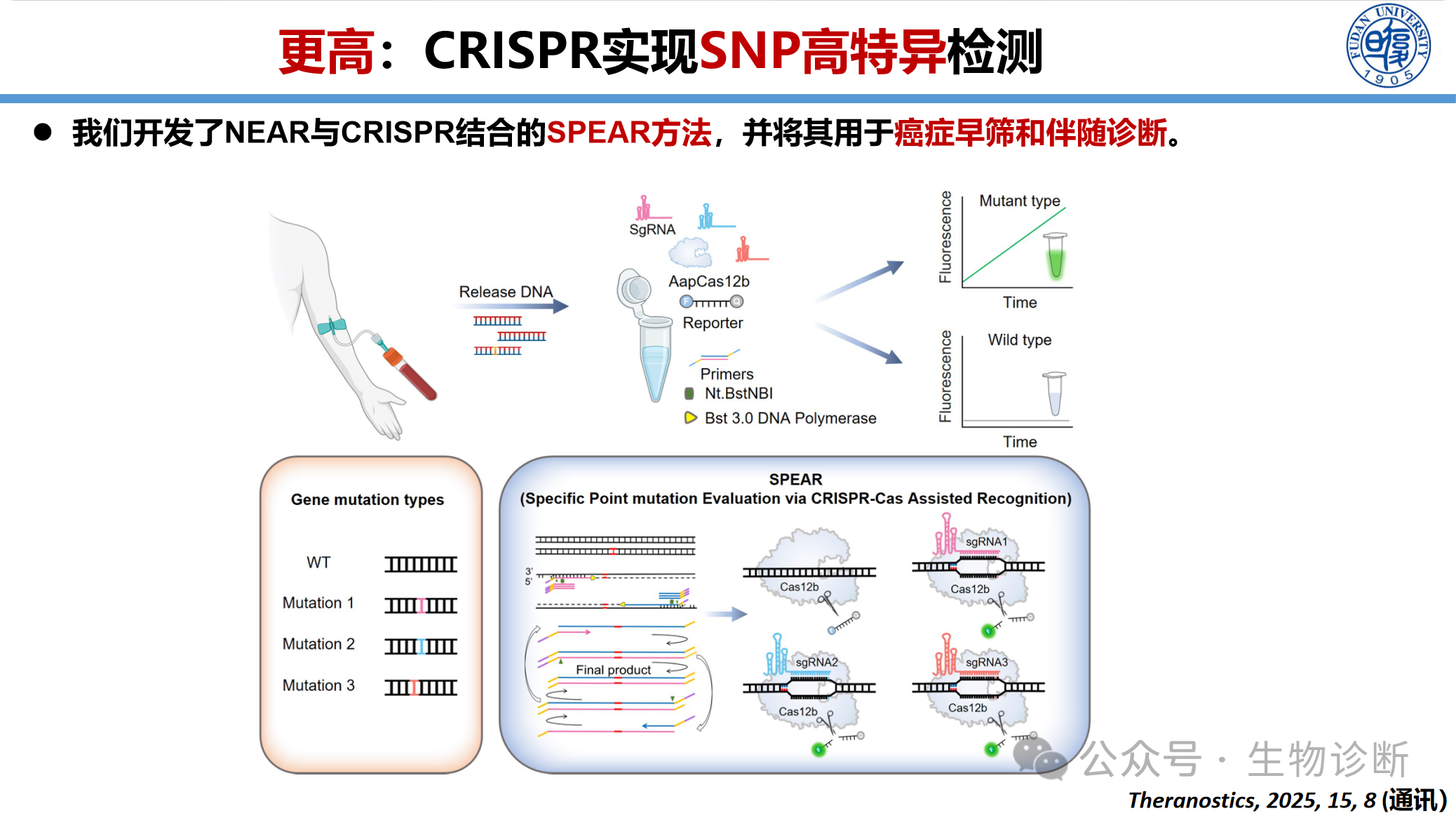
技术原理:NEAR等温扩增与Cas12b切割活性整合,在单管内57℃恒温反应30分钟完成检测
性能优势:可检出0.1%低频突变(1000个野生型中检出1个突变),灵敏度优于Sanger测序(5-10%),与二代测序(NGS)相当,但成本更低、速度更快
应用场景:胰腺癌ctDNA热点突变检测、白血病耐药突变检测
3.2.2 miRNA定量检测
开发CRISPR-微流控联用技术,用于肝癌标志物miR-106a检测:
检测性能:灵敏度达pM级,10分钟内完成自动化定量
技术特点:无需核酸扩增,直接检测,避免扩增偏差
3.3多病原体同步检测
3.3.1 三重一体化检测系统
利用不同Cas酶的PAM偏好性和报告子切割特异性,实现单管三重检测:
技术方案:将不同的Cas酶(如Cas13a, Cas13b, Cas12a)与对应靶标的gRNA预混于同一反应体系中。每种Cas酶被激活后,会切割具有特定碱基偏好的报告子序列。通过对不同报告子标记不同的荧光基团,即可通过荧光信号区分并判断感染了何种病原体
检测性能:10分钟内完成三种病原体同步检测和可视化信号输出
应用实例:HPV16/18/其他高危型分型检测

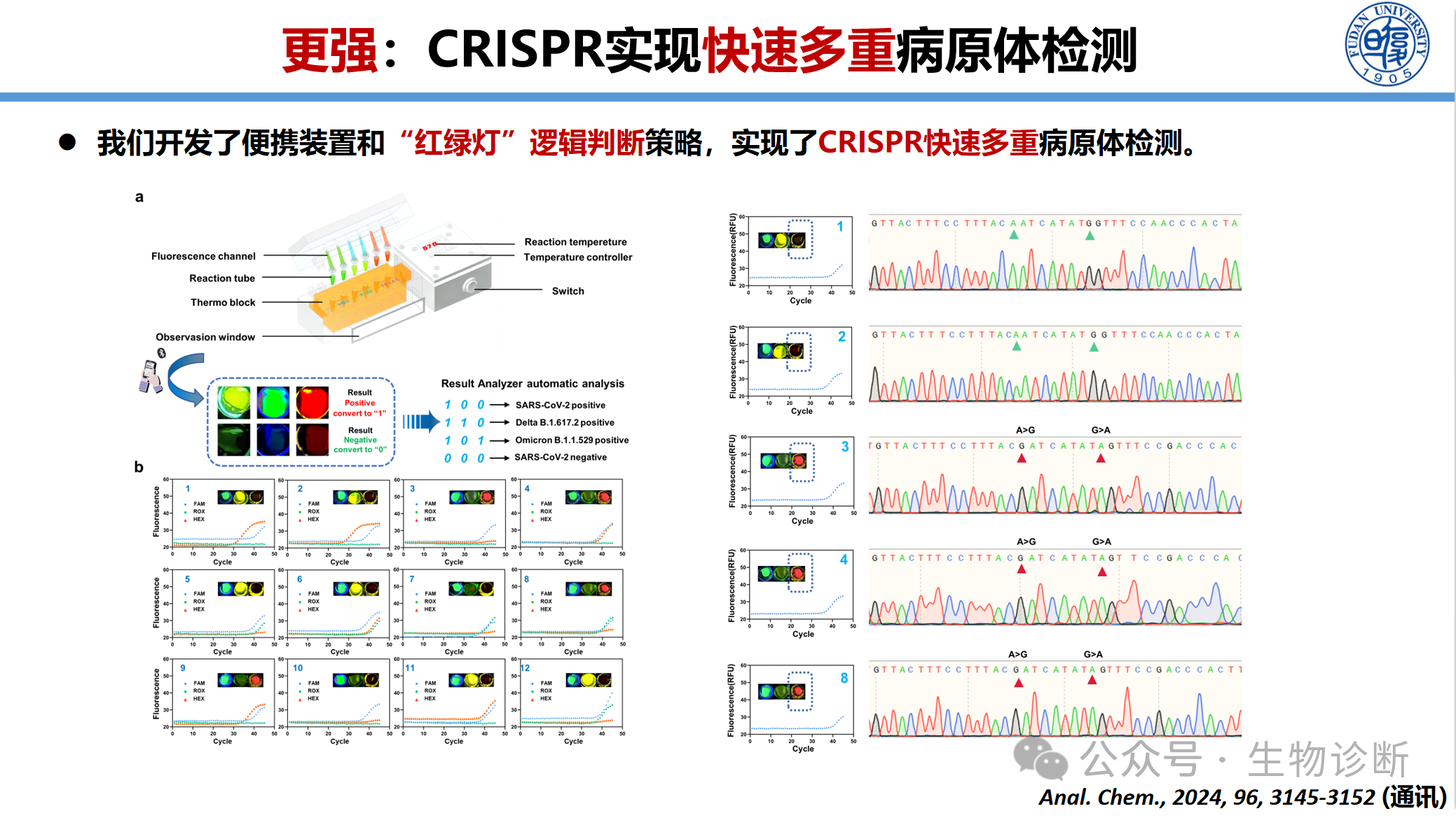
3.3.2“红绿灯”逻辑判断策略
操作流程:样本加入→10分钟恒温孵育→肉眼或手机拍照判读结果
结果输出:红色/绿色荧光信号直观显示感染类型和耐药情况
防污染设计:全程闭管操作,避免气溶胶污染
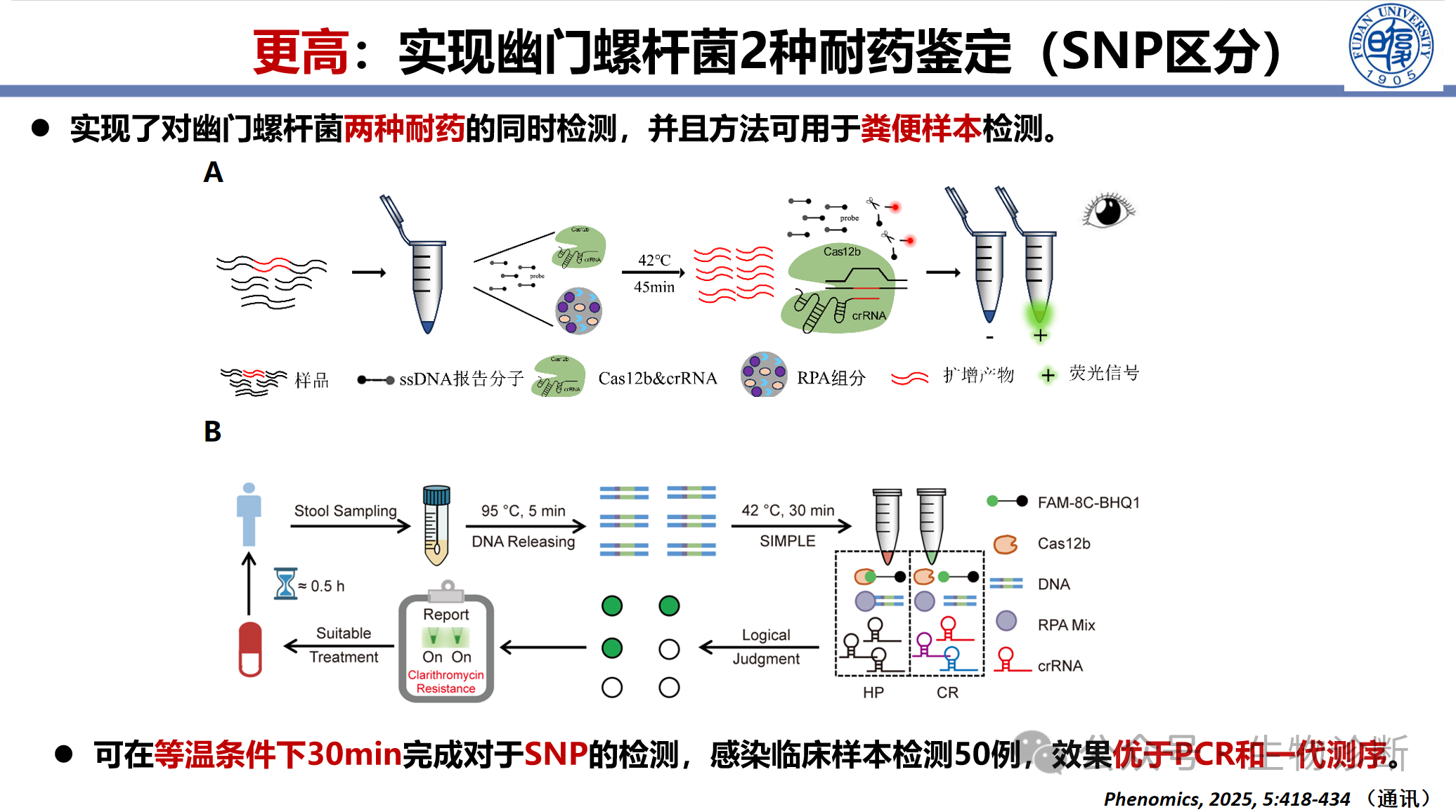
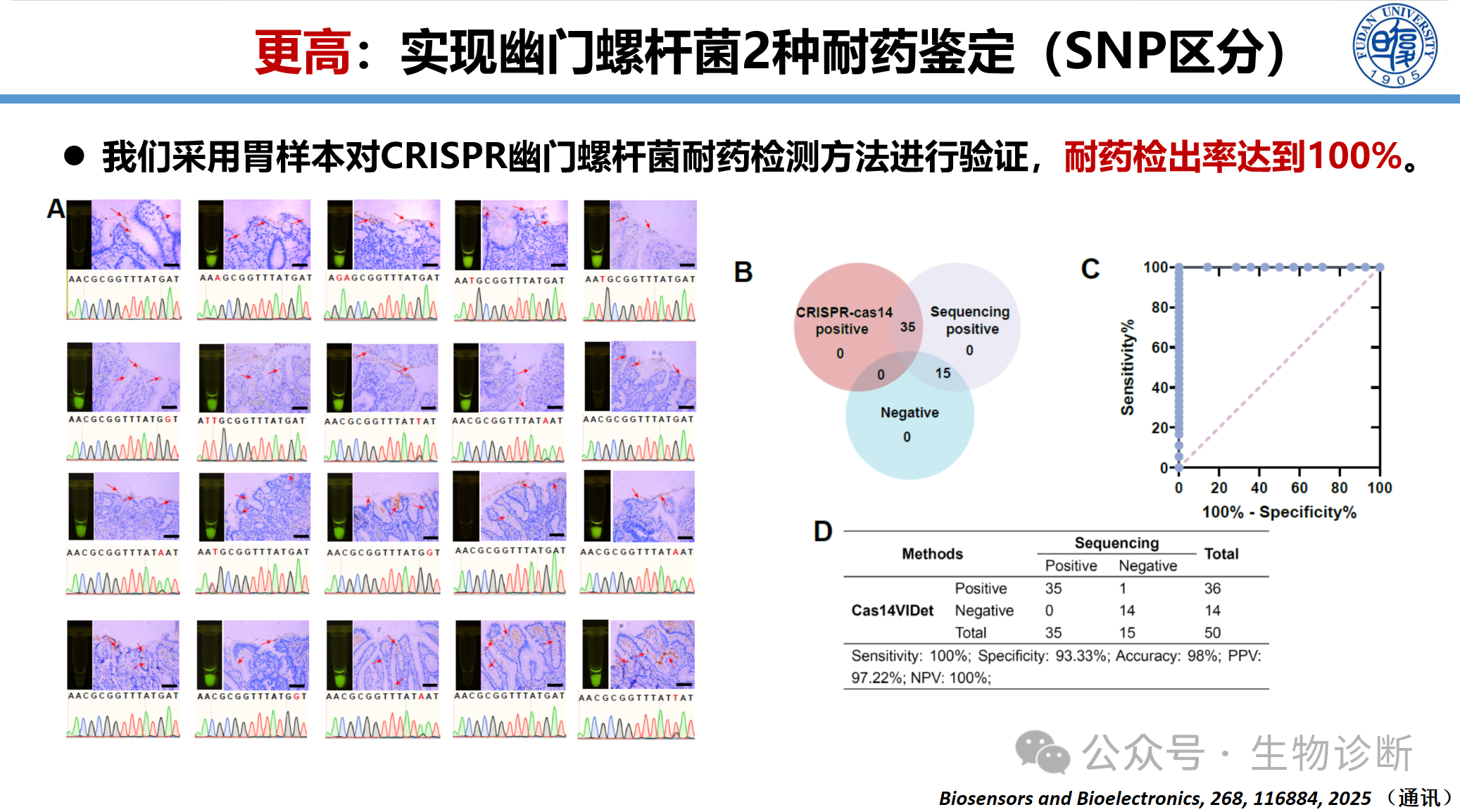
3.4 幽门螺杆菌耐药位点鉴定
建立基于CRISPR的幽门螺杆菌克拉霉素和阿莫西林耐药突变检测方法:
样本类型:粪便样本、胃黏膜样本
性能数据:临床样本验证50例,效果优于PCR和一代测序,同时采用胃样本,耐药检出率达到100%
时间优势:30分钟内完成检测,传统培养法需3天
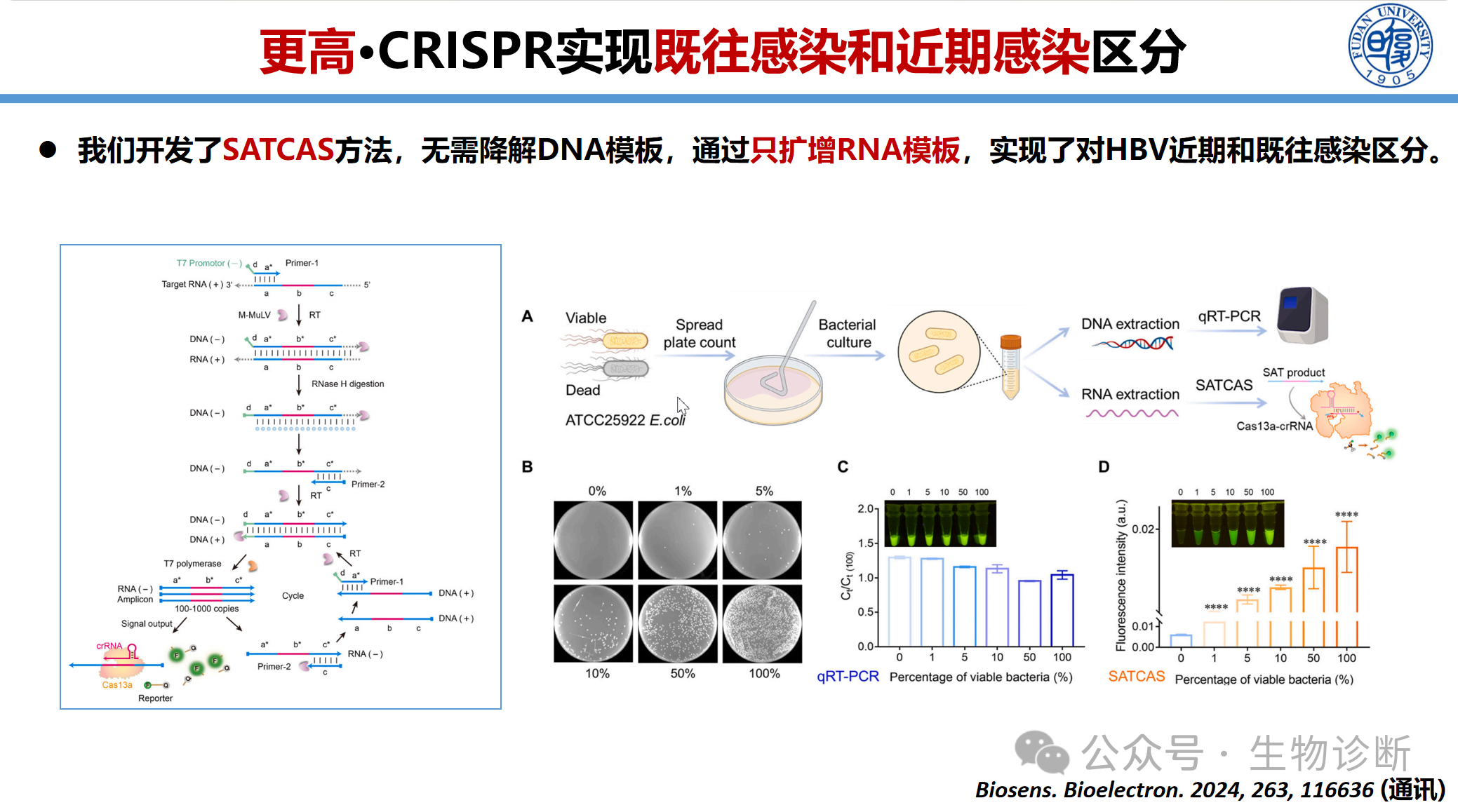
3.5 感染状态区分(SATCAS方法)
开发特异性RNA检测技术(SATCAS)区分HBV既往感染与近期感染:
技术原理:采用仅扩增RNA的等温扩增体系,不降解DNA模板,活病毒产生RNA信号,死亡病毒仅残留DNA
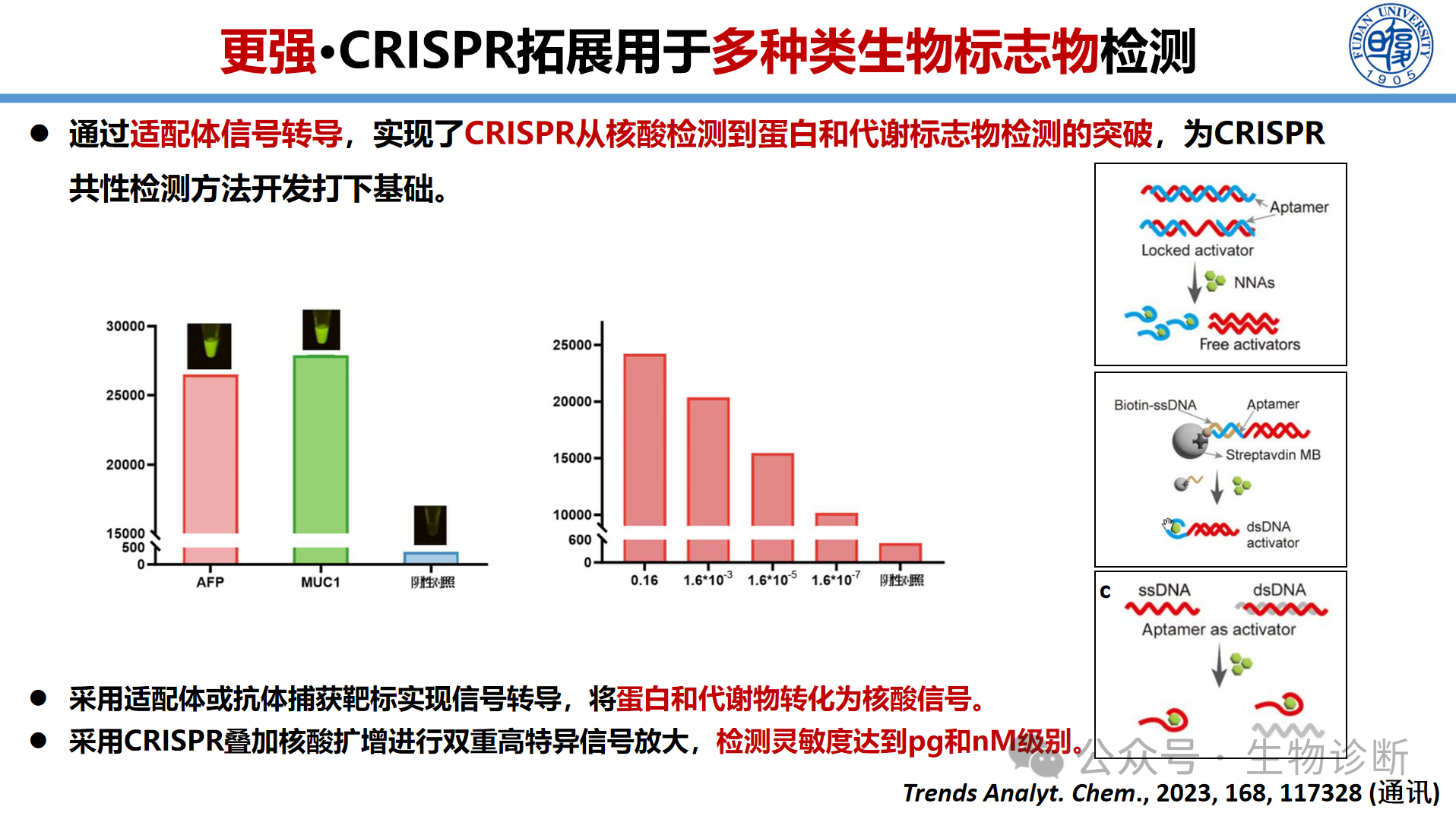
3.6 非核酸靶标:蛋白与代谢物检测
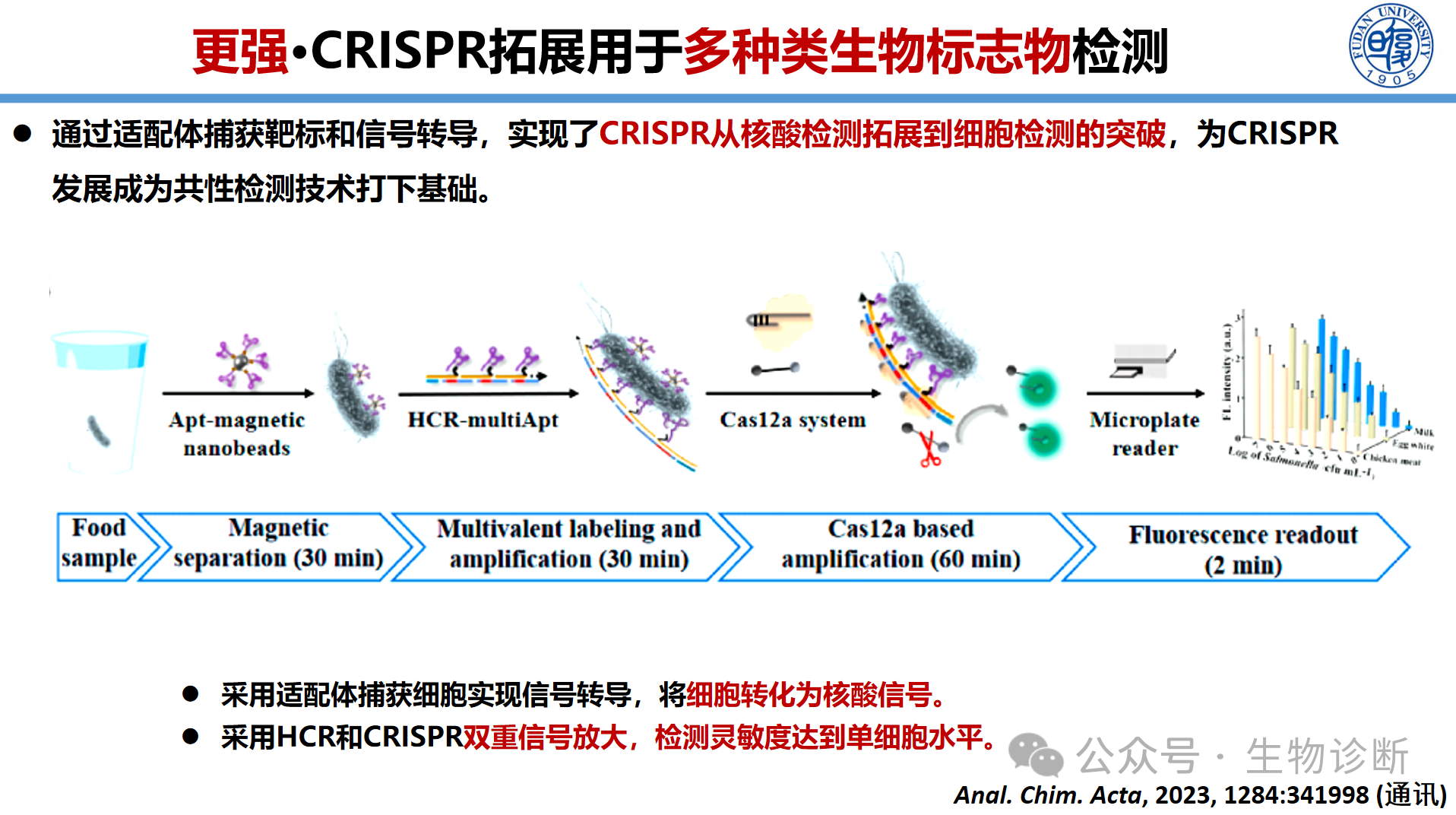
对于蛋白和代谢物等非核酸标志物,通过信号转导策略将靶标信号转换为可被CRISPR系统识别的核酸信号是关键。通过采用适配体(aptamer)替代抗体,利用其特异性捕获靶标蛋白(如肝癌标志物AFP)。捕获后,可直接对适配体序列进行检测,或通过构象变化触发后续核酸反应,最终利用CRISPR系统进行信号放大与输出。实验表明,该方法对AFP等蛋白的检测具有良好的线性关系。将CRISPR与适配体结合,还可将检测拓展至单细胞水平,通过靶向细胞表面特异性蛋白,实现单细胞的灵敏检测。
04
4.1 极速PCR-微流控定量系统
4.1.1可视化DNA分子计数
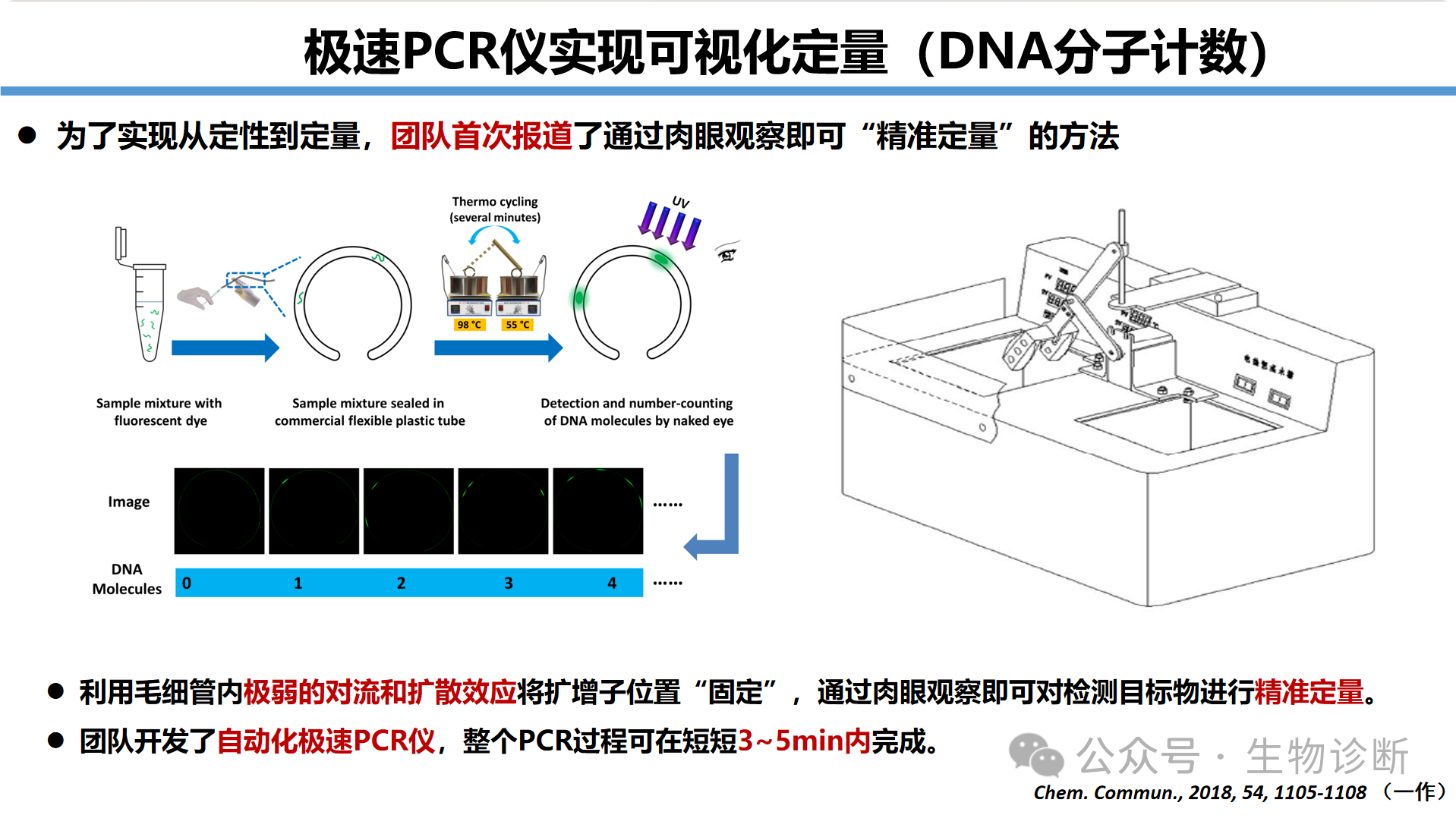
利用毛细管微弱对流扩散效应固定扩增子位置,实现肉眼可见的DNA分子定量:
技术原理:DNA直径2.2-2.6 nm,在毛细管内扩增后形成固定荧光斑点,每个斑点对应单个DNA分子
检测性能:极速PCR仪3-5分钟完成扩增,实现可视化定量检测
局限性:高浓度样本时,光斑重叠,定量精度下降
4.1.2 微流控数字PCR平台
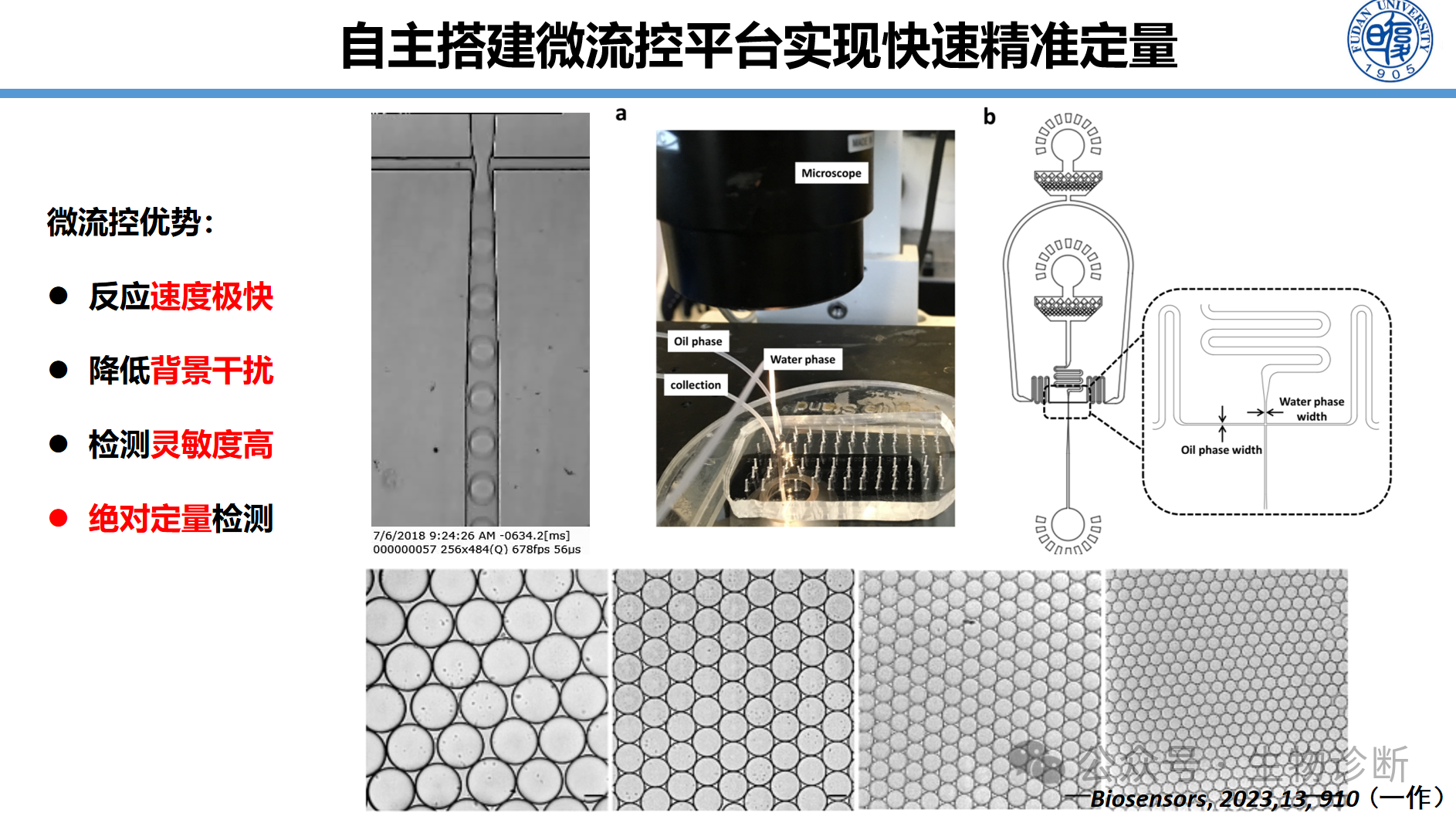
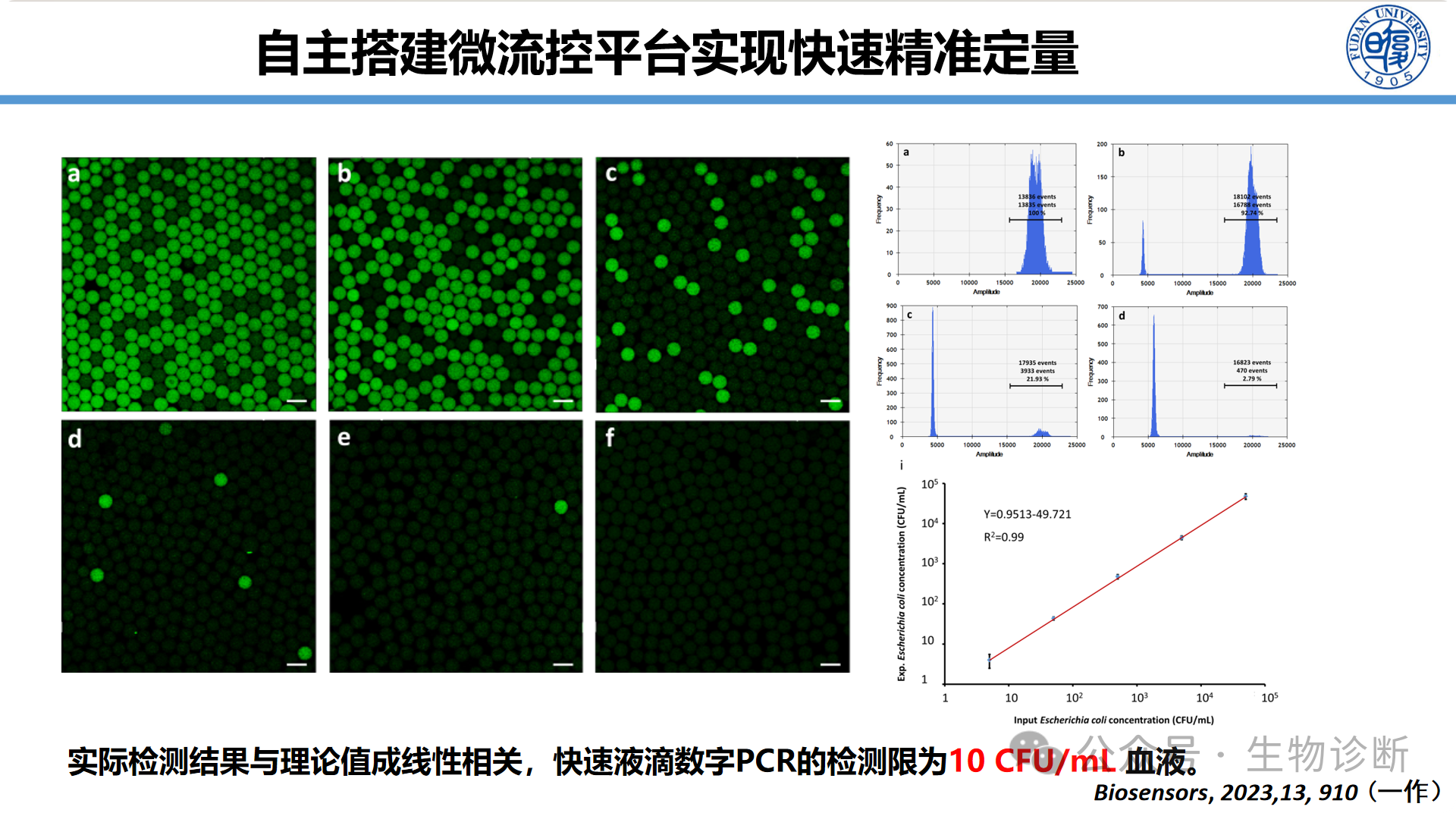
为了实现快速精准定量,自主搭建微流控平台,将样本分散至数百万个皮升级液滴:
技术优势:每个液滴独立反应,实现"相对降噪",检测限达10 CFU/mL血液
绝对定量:实现核酸分子的定量检测
4.2 CRISPR-微流控集成芯片
为实现床旁检测(POCT),我们将扩增与CRISPR检测集成于同一微流控芯片,配合便携式装置,实现了“样本进,结果出”的闭环检测
技术集成:样本核酸提取、等温扩增、CRISPR检测全流程集成
防污染设计:全程闭管操作,避免开盖气溶胶污染
便携性:配套冻干试剂、便携装置和手机分析软件,适用于现场快速检测和资源有限地区。

05
CRISPR技术作为一种共性检测技术平台,其科学意义在于通过源头工具创新,为分子诊断提供新原理;临床意义在于发展创新机制,实现对核酸、蛋白、代谢物等多类标志物的检测;产业意义在于建立创新模型,最终服务于临床健康指标检测与慢病管理。最终目标是让先进的诊断技术“飞入寻常百姓家”,通过提升技术的可及性,为人类健康管理提供普惠、精准的工具。





发表评论 取消回复